网址:http://m.1010jiajiao.com/timu3_id_371108[举报]
| |||||||||||||||||||||||||||
已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。常温下,A、B、C、D为气体。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②D+H2O→C+E
请回答下列问题:
(1)元素Y在元素周期表中的位置为______________;A分子的空间构型是_______;B分子的电子式为___________。
(2)由B气体反应生成1mol A气体时放出的热量为46.2kJ,写出该反应的热化学方程式_____________________________________________________。
(3)D的相对分子质量的理论值总是小于实验测定值的原因是_______________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成。写出该反应的化学方程式___________________________________。在相同条件下,若反应物无剩余,则反应前气体对反应后气体的相对密度为__________(保留到小数点后两位)。
查看习题详情和答案>>①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②D+H2O![]() C+E
C+E
请回答下列问题:
(1)元素Y在元素周期表中的位置为___________________;A分子的空间构型是___________。
(2)由B气体反应生成1 mol A气体时放出的热量为46.2 kJ,写出该反应的热化学方程式
___________________________________________________________________。
(3)D的相对分子质量的理论值总是小于实验测定值的原因是__________________________ ____________________________________________________________________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成。写出该反应的化学方程式_____________。在相同条件下,若反应物无剩余,则反应前气体对反应后气体的相对密度为_____________(保留到小数点后两位)。
查看习题详情和答案>> 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体中,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d能级为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体中,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d能级为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):(1)元素B、C的第一电离能的大小关系是
(2)A的氢化物:A2H4分子中,A原子采取的杂化形式为
(3)单质D和铝的混合粉末mg,与足量氢氧化钠浓溶液充分反应,生成标准状况下气体的体积为VL,则混合粉末中单质D的质量百分数是
m-
| ||
| m |
m-
| ||
| m |
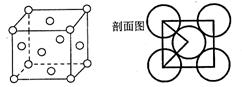
(4)由E元素形成的金属的晶胞结构如图,则该晶胞中含有金属原子的数目为
| 2M |
| (a)3NA |
| 2M |
| (a)3NA |
(10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最多的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E原子的核外电子排布式为 ,A、B、C、D的第一电离能最小的是
(2)B的氧化物的熔点远高于D的氧化物的熔点,理由是
(3)A的最高价含氧酸根离子中,其中心原子是 杂化,D的低价氧化物的空间构型为
(4)A、C形成某种化合物的晶胞结构如右图所示,则其化学式为 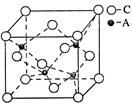
(5)E单质的晶体的晶胞结构如下图。若E原子的半径是r cm,则E单质的密度的计算公式是 (用NA表示阿伏伽德罗常数)