摘要:16.在适宜时期取材.能够观察到植物细胞同源染色体配对现象的实验材料是: A.根尖 B.茎尖 C.花药 D.种子
网址:http://m.1010jiajiao.com/timu3_id_37089[举报]
晶体与非晶体在微观结构上存在着本质区别,这就决定了晶体在宏观上也存在着一些不同于非晶体的独特性质。下列关于晶体性质的叙述中,不正确的是( )
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现封闭规则的多面体几何外形
B.晶体的各向异性和对称性是矛盾的
C.晶体的对称性是微观粒子按一定规律做周期性重复排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
查看习题详情和答案>>下列关于晶体的性质叙述中,不正确的是
[ ]
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现封闭规则的多面体几何外形
B.晶体的各向异性和对称性是矛盾的
C.晶体的对称性是微观粒子按一定规律作周期性的有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
查看习题详情和答案>>
B.晶体的各向异性和对称性是矛盾的
C.晶体的对称性是微观粒子按一定规律作周期性的有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是 .试解释易拉罐变瘪的原因 ;并解释后一现象的原因 .写出反应过程中的两个离子方程式 ; .
查看习题详情和答案>>
有两包白色粉末,分别是K2CO3和NaHCO3,请你写出2种不同的鉴别方法.
(1)
(2)
查看习题详情和答案>>
(1)
取两种少许待检粉末于试管中,分别加热,有CO2气体产生的是NaHCO3或取两种粉末进行焰色反应实验,透过钴玻璃能够观察到紫色火焰的是K2CO3
取两种少许待检粉末于试管中,分别加热,有CO2气体产生的是NaHCO3或取两种粉末进行焰色反应实验,透过钴玻璃能够观察到紫色火焰的是K2CO3
(2)
取两种少许待检粉末于试管中,同时分别在两支试管中加入1mL稀盐酸,放出气体速度快的是NaHCO3
取两种少许待检粉末于试管中,同时分别在两支试管中加入1mL稀盐酸,放出气体速度快的是NaHCO3
.某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
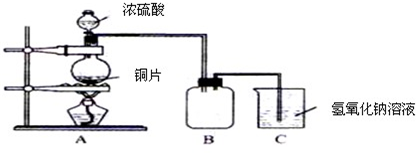
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式:
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
在上述条件下反应能够自发进行,则反应的△H
查看习题详情和答案>>

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
;
| ||
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是
随着反应进行,硫酸被消耗,产物有水生成,所以浓硫酸变成稀硫酸,反应会停止
随着反应进行,硫酸被消耗,产物有水生成,所以浓硫酸变成稀硫酸,反应会停止
;③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:
AD
AD
(填写编号).A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度
不能
不能
(填“能”或“不能”),其理由是虽然甲基橙变色范围:pH为3.1~4.4,氢氧化铜开始沉淀时的pH为5,在指示剂变色范围之外,即中和酸时,铜离子不会消耗OH-,但是甲基橙由红色变成橙色、黄色时,铜离子溶液呈蓝色,对观察指示终点颜色有干扰
虽然甲基橙变色范围:pH为3.1~4.4,氢氧化铜开始沉淀时的pH为5,在指示剂变色范围之外,即中和酸时,铜离子不会消耗OH-,但是甲基橙由红色变成橙色、黄色时,铜离子溶液呈蓝色,对观察指示终点颜色有干扰
.(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
<
<
0(“>”、“<”、“=”).前2h内的平均反应速率v(N2)=1.875×10-4mol?L-1?h-1
1.875×10-4mol?L-1?h-1
,在该温度下,反应的平衡常数K=5000
5000
.据此你认为将该反应从理论转化为现实的最重要的研究方向是寻找高效的催化剂
寻找高效的催化剂
.