网址:http://m.1010jiajiao.com/timu3_id_370784[举报]
| |||||||||||||||
(08闵行区模拟)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是(假设所有反应完全进行):
① 2C + O2 → 2CO
② C + H2O(g) → CO + H2
③ CO + H2O(g) → CO2 + H2
(1)1 kg焦炭按上述反应最多能产生__________m3 H2(标准状况)。
(2)合成氨原料气中的N2是通过反应①除去空气中的氧气所得。现将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4∶1,下同)混合反应,产物气体的组成如下表:
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3) (标准状况) | 21 | 16 | 35 | 60 | 0.1 |
① 计算参加反应的H2O(g)和空气的体积比V(H2O)/V(空气)
② 计算生成上表所列气体时,消耗了___________ kg焦炭。
(3)合成氨厂常用氨和二氧化碳反应生产尿素:2NH3 + CO2 → CO(NH2)2 + H2O
当焦炭、H2O(g)和空气混合反应后的产物混合气体中:
V(CO2)∶V(N2)∶V(H2) = _______________时,原料的利用率最高;
假设上述混合气中CO的体积分数为10%(O2忽略不计)。则生产中投入的原料的物质的量之比是: n(C)∶n(H2O)∶n(空气) = _______________(填最简整数比)。
查看习题详情和答案>>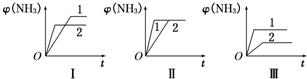
(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应.在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00mol?L-1,c(N2)=3.00mol?L-1,c(NH3)=4.00mol?L-1,此温度下该反应的平衡常数K=
(2)在三个相同容器中各充入1mol N2和3mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示.下列说法中正确的是
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,通过乙醇制取氢气
具有良好的应用前景.已知通过乙醇制取氢气有如下两条路线:
a、CH3CH2OH(g)+H2O(g)?4H2(g)+2CO(g)△H=+255.58kJ/mol
b、CH3CH2OH(g)+1/2O2(g)?3H2(g)+2CO(g)△H=+13.76kJ/mol
下列说法错误的是:
A.从原料消耗的角度来看,a路线制氢更有价值
B.从能量消耗的角度来看,b路线制氢更加有利
C.a路线制氢由于要消耗很多能量,所以在实际生产中意义不大
D.降低温度,可提高b路线中乙醇的转化率.