摘要:I. , II. (1)86 氧化反应 羟基 (2) (3) (4)3
网址:http://m.1010jiajiao.com/timu3_id_370214[举报]
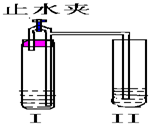 如图所示装置进行实验(图中铁架台等仪器均已略去).在I中加入试剂后,塞紧橡皮塞,立即打开止水夹,II中有气泡冒出;一段时间后关闭止水夹,II 中液面上升,溶液由无色变为浑浊.符合以上实验现象的I和II中应加入的试剂是( ) 如图所示装置进行实验(图中铁架台等仪器均已略去).在I中加入试剂后,塞紧橡皮塞,立即打开止水夹,II中有气泡冒出;一段时间后关闭止水夹,II 中液面上升,溶液由无色变为浑浊.符合以上实验现象的I和II中应加入的试剂是( )
|
查看习题详情和答案>>
在工业上烯烃可以合成多种有机材料.
(1)某同学设计了由乙烯合成合成Y的3条路线(I、II、III)如下图所示.
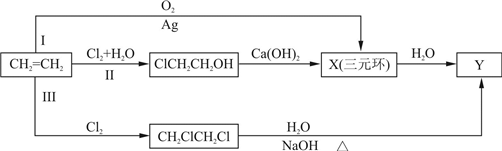
①3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、“II”或“III”)
②X的结构简式是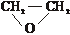
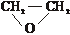 .
.
(2)已知Q为乙烯的同系物,以Q和X为原料合成M的方法如下:
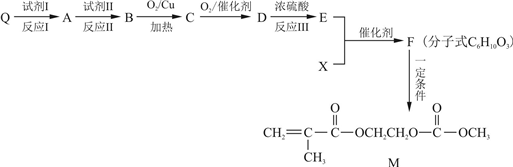
请回答下列问题:
①Q的名称是
②E中含有官能团的名称是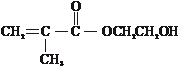
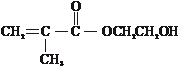 .
.
③写出M与足量氢氧化钠溶液反应的化学方程式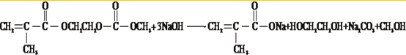
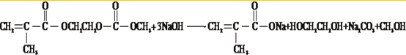 .
.
④已知: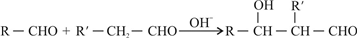 且 C+CH3CHO
且 C+CH3CHO
G,G的同分异构体有多种,写出符合下列条件的G的所有同分异构体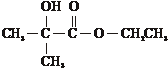 、
、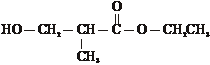
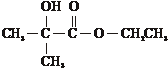 、
、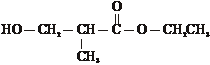
a.与钠反应放出氢气
b.在酸性条件下水解为N和乙醇
c.N中含有支链.
查看习题详情和答案>>
(1)某同学设计了由乙烯合成合成Y的3条路线(I、II、III)如下图所示.

①3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、“II”或“III”)
I
I
.②X的结构简式是
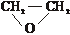
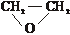
(2)已知Q为乙烯的同系物,以Q和X为原料合成M的方法如下:

请回答下列问题:
①Q的名称是
2-甲基丙烯
2-甲基丙烯
②E中含有官能团的名称是
碳碳双键、羧基
碳碳双键、羧基
,F的结构简式是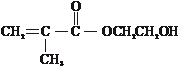
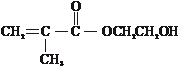
③写出M与足量氢氧化钠溶液反应的化学方程式
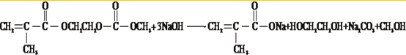
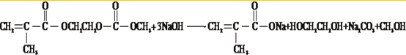
④已知:
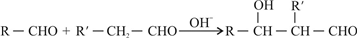 且 C+CH3CHO
且 C+CH3CHO| OH- |
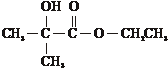 、
、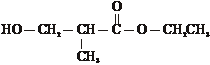
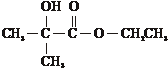 、
、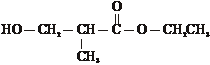
a.与钠反应放出氢气
b.在酸性条件下水解为N和乙醇
c.N中含有支链.
某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式固体B
(3)写出①、④两个反应的化学方程式
①
(4)写出②、③两个反应的离子方程式
②
(5)设计实验检验溶液F中所含溶质:
(6)分别写出Al2O3和Fe2O3在工业上的一种主要用途:Al2O3
查看习题详情和答案>>

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是
过滤
过滤
.(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式固体B
Al2O3
Al2O3
;沉淀DFe2O3
Fe2O3
;溶液EK2SO4和(NH4)2SO4
K2SO4和(NH4)2SO4
.(3)写出①、④两个反应的化学方程式
①
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2NaOH=2NaAlO2+H2O
;④2Al(OH)3
Al2O3+3H2O
| ||
2Al(OH)3
Al2O3+3H2O
.
| ||
(4)写出②、③两个反应的离子方程式
②
Al3++3NH3?H2O=Al(OH)3↓+3 NH4+
Al3++3NH3?H2O=Al(OH)3↓+3 NH4+
;③AlO2-+H++H2O=Al(OH)3↓
AlO2-+H++H2O=Al(OH)3↓
.(5)设计实验检验溶液F中所含溶质:
取F溶液少许于两支试管中,一支中滴加KSCN溶液,若显血红色证明F溶液中含有Fe3+;在另一支试管中加入稀硝酸酸化然后再加入硝酸银溶液,若有白色沉淀生成证明F溶液中含有Cl-
取F溶液少许于两支试管中,一支中滴加KSCN溶液,若显血红色证明F溶液中含有Fe3+;在另一支试管中加入稀硝酸酸化然后再加入硝酸银溶液,若有白色沉淀生成证明F溶液中含有Cl-
.(6)分别写出Al2O3和Fe2O3在工业上的一种主要用途:Al2O3
冶炼铝、耐火材料
冶炼铝、耐火材料
Fe2O3炼铁原料、红色油漆、涂料
炼铁原料、红色油漆、涂料
.下列表为元素周期表中的一部分,表中列出8种元素在周期表中的位置,请用化学用语回答下列问题.
(1)在①~⑧元素中化学性质最不活泼的元素符号是 ,金属性最强的是 .
(2)①、②、③、⑤、⑦五种元素中的原子半径由大到小的顺序是 .
①、②、③、⑦四种元素形成的离子,离子半径由大到小的顺序是 .
(3)④与⑥元素按原子个数比1:2形成的化合物的结构式为 .
(4)①、②、③、⑤、⑦五种元素最高价氧化物对应的水化物中,碱性最强的是 ,酸性最强的是 ,写出二者发生反应的离子方程式 .
(5)①的最高价氧化物与⑥的氢化物之间反应的化学方程式 .
查看习题详情和答案>>
族 周期 |
I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
(2)①、②、③、⑤、⑦五种元素中的原子半径由大到小的顺序是
①、②、③、⑦四种元素形成的离子,离子半径由大到小的顺序是
(3)④与⑥元素按原子个数比1:2形成的化合物的结构式为
(4)①、②、③、⑤、⑦五种元素最高价氧化物对应的水化物中,碱性最强的是
(5)①的最高价氧化物与⑥的氢化物之间反应的化学方程式
(1)写出下图中序号①~④仪器的名称:
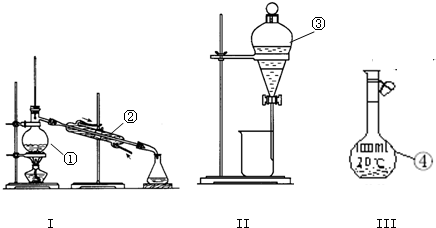
①
(2)仪器①~④中,使用时必须检查是否漏水的是
装置I、II、III中需要检查气密性是
(3)分离碘水中的碘应先选择装置
(4)现欲用98%的浓硫酸(密度为1.84g?cm-3)配制成浓度为1.0mol?L-1的稀硫酸100mL.
①所需仪器除烧杯、玻璃棒外还需
②所取浓硫酸的体积为
查看习题详情和答案>>

①
蒸馏烧瓶
蒸馏烧瓶
; ②冷凝管
冷凝管
; ③分液漏斗
分液漏斗
; ④100mL容量瓶;
100mL容量瓶;
;(2)仪器①~④中,使用时必须检查是否漏水的是
③④
③④
.(填仪器序号)装置I、II、III中需要检查气密性是
蒸馏装置
蒸馏装置
.(填装置名称)(3)分离碘水中的碘应先选择装置
II
II
(填装置序号)进行萃取
萃取
和分液
分液
操作,再用装置I
I
(填装置序号)进行蒸馏
蒸馏
操作.(4)现欲用98%的浓硫酸(密度为1.84g?cm-3)配制成浓度为1.0mol?L-1的稀硫酸100mL.
①所需仪器除烧杯、玻璃棒外还需
10mL量筒
10mL量筒
、100mL容量瓶
100mL容量瓶
、胶头滴管
胶头滴管
.②所取浓硫酸的体积为
5.4
5.4
mL.(保留一位小数)