网址:http://m.1010jiajiao.com/timu3_id_370030[举报]
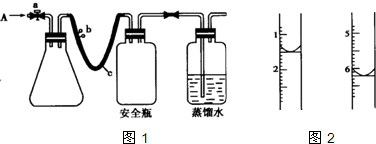
(1)用如图1所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是
②用注射器抽取20.00mL 某水样从A 处注入锥形瓶.
③再分别从A 处注入含m molNaOH的溶液及过量的MnSO4溶液.
④完成上述操作后,下面应振荡锥形瓶.
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O.实验步骤:
⑤打开止水夹a、b,分别从A 处注入足量NaI溶液及含n mol H2SO4的硫酸溶液.
⑥重复④的操作.
(3)用Na2S2O3 标准溶液滴定步骤(2)中生成的I2,反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6.
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴
⑧用0.005mol?L-1Na2S2O3 滴定至终点.
(4)计算.滴定过程中,滴定前后滴定管中的液面读数如图2所示.
⑨经计算,此水样中氧(O2)的含量为(单位:mg?L-1)
⑩本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定量的关系,即应加适量H2SO4使溶液呈
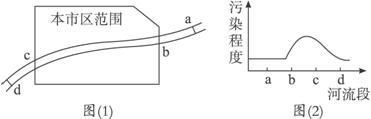
(1)造成X河污染的主要污染源最可能分布在( )
A.ab段 B.bc段 C.cd段 D.bd段
(2)列举造成X河污染的三种可能的污染源。
(3)对c处水样进行检测,发现其中含有Cu2+等重金属离子。若要把铜离子变为单质铜回收,请回答两种回收的方法:
方法Ⅰ:_____________________________,方法Ⅱ:________________________。
(4)d处污染程度明显降低,请从物理、化学、生物学三个方面简单分析其原因。
查看习题详情和答案>>(10分)已知 2 mol SO2 (g) 氧化为2 mol SO3 (g) 的能量变化如图所示:
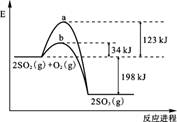
(1)写出SO2 (g) 氧化为SO3 (g) 的热化学方程式:
(2)氧化SO2时,工业上常加入V2O5作催化剂,其反应机理可表示为
SO2 + V2O5 = SO3 + 2VO2 , 4VO2 + O2 = 2V2O5 ;
上图中表示加入V2O5的反应曲线为 (填“a”或“b”)。
(3)若在容积为2 L的密闭容器中充入2 mol SO2 (g)和1 mol O2 (g),如图甲所示,经2 min达到平衡,测得放出热量为178.2 kJ,则:

①2 min内 O2的化学反应速率v(O2)= ;
②若再充入1 mol O2重新达到平衡时,SO3平衡浓度的取值范围是: 。
(4)若将2 mol SO2 (g)和1 mol O2 (g)充入容积可变的容器乙中,初始体积为2 L,达到平衡时放出热量Q kJ,则Q 178.2 kJ(填“>”,“=”或“<”)。
查看习题详情和答案>>
(10分)已知 2 mol SO2 (g) 氧化为2 mol SO3 (g) 的能量变化如图所示:
(1)写出SO2 (g) 氧化为SO3 (g) 的热化学方程式:
(2)氧化SO2时,工业上常加入V2O5作催化剂,其反应机理可表示为
SO2 + V2O5 = SO3 + 2VO2, 4VO2 + O2 = 2V2O5;
上图中表示加入V2O5的反应曲线为 (填“a”或“b”)。
(3)若在容积为2 L的密闭容器中充入2 mol SO2 (g)和1 mol O2 (g),如图甲所示,经2 min达到平衡,测得放出热量为178.2 kJ,则:
①2 min内 O2的化学反应速率v(O2)= ;
②若再充入1 mol O2重新达到平衡时,SO3平衡浓度的取值范围是: 。
(4)若将2 mol SO2 (g)和1 mol O2 (g)充入容积可变的容器乙中,初始体积为2 L,达到平衡时放出热量Q kJ,则Q 178.2 kJ(填“>”,“=”或“<”)。