网址:http://m.1010jiajiao.com/timu3_id_369746[举报]
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的等电子体是 (写一种)。LiBH4中不存在的作用力有___(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_ _____。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
| I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是______(填元素符号)。
(3)某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有____种。

(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HF 。
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X—定不是______(填标号)。
A.H2O B.CH4 C.HF D.CO(NH2)2
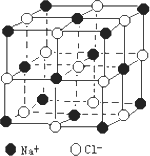
(5)纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同。则这种纳米颗粒的表面粒子数占总粒子数的百分数为 。
A.87.5% B.92.9% C.96.3% D.100%
已知NaCI的摩尔质量为58。5g.mol-1,食盐晶体的密度为pg.Cm-3,如图所示为氯化钠晶体的晶胞,若图中N与最邻近的CI-的核间距离为a cm,那么:
 (1)阿伏加德罗常数的值可表示为
(1)阿伏加德罗常数的值可表示为
。
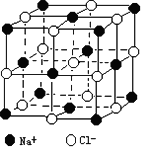
(2)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子数与总原子数和比值为 。
查看习题详情和答案>>随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高.现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m g NaCl固体并转移到定容仪器A中 ②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为V mL
回答下列问题:
(1)步骤①中A仪器最好用________(填仪器名称)
(2)能否用胶头滴管代替步骤②中的滴定管?其原因是________
(3)能否用水代替苯________________理由是________________
(4)已知NaCl晶胞的结构如图所示,经X射线衍射测得晶胞中最邻近的Na+和C1-平均距离为a cm,则利用上述方法测得的阿伏加德罗常数的表达式为NA=________.

(5)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分比为________.
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||