摘要:23.FeCl3的浓溶液溶解铜粉的离子方程式为:2Fe3++Cu=2Fe2++Cu2+.现向FeCl3溶液中加入ag铜粉.搅拌使之全部溶解.再向其中加入bg铁粉.经充分反应后.过滤.得cg滤渣.若已知a>b>c.试推断滤渣是 .滤液中的金属离子是 . 24.三氯化铁是中学化学实验室中必不可少的重要试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O.该同学设计的实验装置如右图所示.A中放有废铁屑.烧杯中盛有过量的稀硝酸.实验时打开a.关闭b.从分液漏斗内向A中滴加过量盐酸.YC此时溶液呈浅绿色.再打开b 进行过滤.过滤结束后.取烧杯内溶液倒入蒸发皿加热.蒸发掉部分开水并使多余HNO3分解.再降温结晶得FeCl3·6H2O晶体.请填写下列空白: (1)从B导管收集产生的气体可采用的方法是 . (2)滴加盐酸时.发现反应速率比盐酸与纯铁粉反应要快. 其原因是 . (3)烧杯内放过量稀HNO3的原因是 . 离子方程式是 . (4)整个实验过程中.弹簧夹a都必须打开.除了为排出产生 的气体外.另一个目的是 . (5)用降温结晶法制得FeCl3·6H2O.而不用直接蒸干的方法来 制得晶体的理由 .
网址:http://m.1010jiajiao.com/timu3_id_369609[举报]
FeCl3的浓溶液溶解铜粉的离子方程式为:2Fe3++Cu=2Fe2++Cu2+.现向FeCl3溶液中加入ag铜粉,搅拌使之全部溶解,再向其中加入bg铁粉,经充分反应后,过滤,得cg滤渣.若已知a>b>c,试推断滤渣是________,滤液中的金属离子是________.
 (2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,
(2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出该反应的离子方程式
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
.(2)高炉炼铁过程中会发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g).
已知:Fe(s)+
| 1 | 2 |
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-22lkJ?mol-1
则:①FeO(s)+CO(g)?Fe(s)+CO2(g)△H=
一1lkJ?mol-1
一1lkJ?mol-1
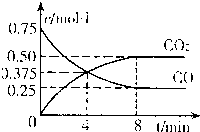
.②一定温度下,向某密闭容器中加入足量FeO,并充入一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
则从开始至达到平衡过程中,v(CO)=
0.625mol?L-1?min-1
0.625mol?L-1?min-1
;该温度下,FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数K=2
2
.(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol?L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
11.2g
11.2g
.类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2.为验证此观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分.探究过程如下:
(1)提出假设:A是FeCl3,B是FeCl2.
(2)设计实验方案:分别取A、B的溶液均进行以下实验,但实验现象相同.请填写下表中的相应空格
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是
A.将A溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)FeCl3溶液常作印刷电路铜板腐蚀剂,写出反应的离子方程式
方案1:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜,该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出.该方案中铜作
查看习题详情和答案>>
(1)提出假设:A是FeCl3,B是FeCl2.
(2)设计实验方案:分别取A、B的溶液均进行以下实验,但实验现象相同.请填写下表中的相应空格
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
2Fe+3Cl2
FeCl3
| ||
2Fe+3Cl2
FeCl3
.
| ||
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是
BD
BD
(填写序号).A.将A溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)FeCl3溶液常作印刷电路铜板腐蚀剂,写出反应的离子方程式
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
.腐蚀后的废液中含有FeCl2、FeCl3、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收Cu的方案:方案1:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜,该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:
Fe3+>Cu2+>H+>Fe2+
Fe3+>Cu2+>H+>Fe2+
.方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出.该方案中铜作
阴
阴
极,该电极上所发生的电极反应为 (若有多个电极反应,请全部写出)Fe3++e-=Fe2+,Cu2++2e-=Cu,2H++2e-=H2↑
Fe3++e-=Fe2+,Cu2++2e-=Cu,2H++2e-=H2↑
.方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:产生污染性的气体氯气;使用了电解装置成本较高
产生污染性的气体氯气;使用了电解装置成本较高
.现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用.某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下.其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段.
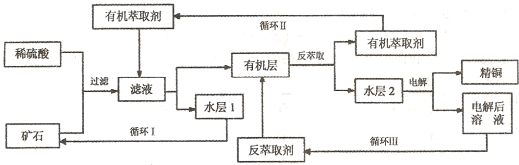
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液.回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等.某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个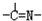 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=

(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式
(5)该工艺最大亮点是它符合下列原理
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒 E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称.由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚.某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:
①铁片置于硫酸铜溶液中有铜析出;
②铁、铜和氯气反应分别生成FeCl3和CuCl2;
③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;
④铜片置于FeCl3溶液中铜片逐渐溶解;
⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;
⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生.
以上设计合理的有
A.两种方案 B.三种方案 C.四种方案 D.五种方案.
查看习题详情和答案>>

已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液.回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O
CuO+2H+═Cu2++H2O
CuO+2H+═Cu2++H2O
、Fe2O3+6H+═2Fe3++3H2O,Cu+2Fe3++2Fe2++Cu2+,
Fe2O3+6H+═2Fe3++3H2O,Cu+2Fe3++2Fe2++Cu2+,
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式
4Fe2++O2+4H+=4Fe3++2H2O
4Fe2++O2+4H+=4Fe3++2H2O
.(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等.某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个
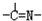 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=n1+n2-2
n1+n2-2
.若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是

(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式
4OH--4e-=2H2O+O2
4OH--4e-=2H2O+O2
(5)该工艺最大亮点是它符合下列原理
B
B
.A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒 E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称.由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚.某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:
①铁片置于硫酸铜溶液中有铜析出;
②铁、铜和氯气反应分别生成FeCl3和CuCl2;
③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;
④铜片置于FeCl3溶液中铜片逐渐溶解;
⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;
⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生.
以上设计合理的有
A
A
.A.两种方案 B.三种方案 C.四种方案 D.五种方案.
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下,请回答下列问题: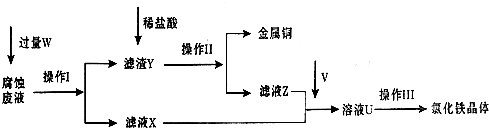
(1)请写出FeCl3溶液与铜反应的离子方程式:
(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol?L-1 的浓盐酸配制250mL 1mol?L-1 的稀盐酸,并进行有关实验.
①需要量取浓盐酸
②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视
(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式:
(4)操作Ⅲ应在HCl气流氛围中进行,其原因是
(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀.该过程中调节溶液的pH为5,则金属离子浓度为
查看习题详情和答案>>

(1)请写出FeCl3溶液与铜反应的离子方程式:
2Fe3++Cu═2Fe2++Cu2+
2Fe3++Cu═2Fe2++Cu2+
;操作Ⅰ加入的试剂W是铁粉或Fe
铁粉或Fe
.(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol?L-1 的浓盐酸配制250mL 1mol?L-1 的稀盐酸,并进行有关实验.
①需要量取浓盐酸
25mL
25mL
mL.②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
.③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视
锥形瓶内溶液颜色的变化
锥形瓶内溶液颜色的变化
,实验时未用标准液润洗滴定管,测得锥形瓶中待测液的浓度大于
大于
实际浓度.(填“>”、“<”或“=”).(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
,该反应中
| ||
MnO2
MnO2
是氧化剂.(4)操作Ⅲ应在HCl气流氛围中进行,其原因是
抑制Fe3+(或FeCI3)的水解
抑制Fe3+(或FeCI3)的水解
.(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2或Fe2+
FeCl2或Fe2+
.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,溶液显红色,则表明溶液U中有Fe3+(FeCl3);另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液退色,则表明溶液U中有Fe2+(或FeCl2),说明通入的V的量不足够若KMnO4溶液不退色,则说明通入的V的量充足
取少量溶液U,加入几滴KSCN溶液,溶液显红色,则表明溶液U中有Fe3+(FeCl3);另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液退色,则表明溶液U中有Fe2+(或FeCl2),说明通入的V的量不足够若KMnO4溶液不退色,则说明通入的V的量充足
(简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀.该过程中调节溶液的pH为5,则金属离子浓度为
4.0×10-11mol?L-1
4.0×10-11mol?L-1
.(己知:Ksp[Fe(OH)3]=4.0×10-38)