网址:http://m.1010jiajiao.com/timu3_id_369360[举报]
(10分)海水中化学资源的综合开发利用已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的步骤:

请回答:
I.从海水中提取的溴占世界年产量的1/3,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时,第一次通入Cl2发生反应的离子方程式是__________________。
(2)吸收塔中反应的离子方程式是________________________________________。
由(1)、(2)可知,SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
__________________。( 用“”表示)
II.镁及其合金是用途很广泛的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用___________(写化学式)。
(2)加入试剂②后反应泊离子方程式是_________________________________。
(3)步骤①包括加热、蒸发、冷却、结晶、_________。
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是
___________________________________________________。
III.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸。生产方法是:
①将氯化镁晶体(MgCl2·6H2O)加热到523OC以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体。
②将两种气体冷却到室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸。
(1)MgCl2·6H2O在523OC以上分解的化学方程式是_____________________________。
(2)现用1mol MgCl2·6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水__________g(精确到0.1),该盐酸中溶质的物质的量浓度是____________mol/L(精确到0.1)。
查看习题详情和答案>>
(10分)某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答。
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品。
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有______________________。
③用________、量取10.00ml待测液,注入锥形瓶中。
④在锥形瓶中滴入2~3滴________(填指示剂),用0.2010 mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转____式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。
(2)实验过程中,下列操作将造成待测烧碱溶液浓度偏高的是_______________。
①量取待测液的滴定管没有用待测液润洗 ②锥形瓶水洗后又用待测液润洗
③未用标准盐酸溶液润洗滴定管 ④滴定过程中振荡时有液滴溅出
⑤滴定前盛装标准盐酸溶液的滴定管尖嘴部分无气泡,滴定后有气泡
⑥滴定前仰视读数,滴定后俯视读数
(3)该小组测得下列数据
|
滴定次数 |
待测液体积/ml |
标准盐酸体积/ml |
|
|
滴定前读数/ml |
滴定后读数/ml |
||
|
第一次 |
10.00 |
0.20 |
22.90 |
|
第二次 |
10.00 |
0.50 |
20.40 |
|
第三次 |
10.00 |
4.00 |
24.10 |
|
第四次 |
10.00 |
0.00 |
20.00 |
根据上述数据,计算烧碱的纯度______________。
查看习题详情和答案>>
(10分)某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答。
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品。
②将样品配 成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有______________________。
成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有______________________。
③用________、量取10.00ml待测 液,注入锥形瓶中。
液,注入锥形瓶中。
④在锥形瓶中滴入2~3滴________(填指示剂),用0.2010 mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转____式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。
(2)实验过程中,下列操作将造成待测烧碱溶液浓度偏高的是_______________。
①量取待测液的滴定管没有用待测液润洗 ②锥形瓶水洗后又用待测液润洗
③未用标准盐酸溶液润洗滴定管 ④滴定过程中振荡时有液滴溅出
⑤滴定前盛装标准盐酸溶液的滴定管尖嘴部分无气泡,滴定后有气泡
⑥滴定前仰视读数,滴定后俯视读数
(3)该小组测得下列数据
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
(10分)某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答。
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品。
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有______________________。
③用________、量取10.00ml待测液,注入锥形瓶中。
④在锥形瓶中滴入2~3滴________(填指示剂),用0.2010mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转____式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。
(2)实验过程中,下列操作将造成待测烧碱溶液浓度偏高的是_______________。
①量取待测液的滴定管没有用待测液润洗 ②锥形瓶水洗后又用待测液润洗
③未用标准盐酸溶液润洗滴定管 ④滴定过程中振荡时有液滴溅出
⑤滴定前盛装标准盐酸溶液的滴定管尖嘴部分无气泡,滴定后有气泡
⑥滴定前仰视读数,滴定后俯视读数
(3)该小组测得下列数据
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
根据上述数据,计算烧碱的纯度______________。
查看习题详情和答案>>
(10分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ―Ⅳ所示。
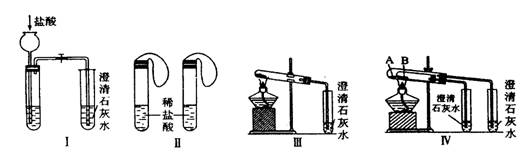
(1) 只根据图I、II所示实验,能够更好的达到实验目的是(填装置序号)__________;
(2)图III、IV所示实验均能鉴别这两种物质,其反应的化学方程式为_____ ;与实验III相比,实验IV的优点是(填选项序号)_______________;
A.IV比III复杂
B.IV比III安全
C.IV比III操作简便
D.IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为___________________ ;
②当碳酸氢钠与氢氧化钙物质的量之比为2 : 1时,所得溶液中溶质的化学式为_________,请设计实验检验所得溶液中溶质的阴离子 。
查看习题详情和答案>>