网址:http://m.1010jiajiao.com/timu3_id_369062[举报]
 当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
。
⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
28. (9分)下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择
A. M>N B. M<N C. M=N D. 无法比较
⑴相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5mol·L-1NH4Cl溶液中NH4+的个数: ;
⑵相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度: ;
⑶两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+): ;
⑷常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
⑸将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ;
⑹常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-): ;
⑺同温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+ 的水解百分率: ;
⑻室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,原酸溶液和原碱溶液的物质的量浓度: ;
⑼PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同, 则M和N的关系是: 。
查看习题详情和答案>>
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
28. (9分)下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择
A. M>N B.M<N C.M=N D. 无法比较
⑴相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5mol·L-1NH4Cl溶液中NH4+的个数: ;
⑵相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度: ;
⑶两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+): ;
⑷常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
⑸将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ;
⑹常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-): ;
⑺同温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+ 的水解百分率: ;
⑻室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,原酸溶液和原碱溶液的物质的量浓度: ;
⑼PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同, 则M和N的关系是: 。
查看习题详情和答案>>
 当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
28.(9分)下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择
A. M>N B. M<N C. M="N" D. 无法比较
⑴相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5mol·L-1NH4Cl溶液中NH4+的个数: ;
⑵相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度: ;
⑶两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+): ;
⑷常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
⑸将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ;
⑹常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-): ;
⑺同 温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率: ;
温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率: ;
⑻室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7, 原酸溶液和原碱溶液的物质的量浓度: ;
原酸溶液和原碱溶液的物质的量浓度: ;
⑼PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是: 。
 当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
28.(9分)下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择
A. M>N B. M<N C. M="N" D. 无法比较
⑴相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5mol·L-1NH4Cl溶液中NH4+的个数: ;
⑵相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度: ;
⑶两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+): ;
⑷常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
⑸将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ;
⑹常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-): ;
⑺同
 温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率: ;
温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率: ;⑻室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,
 原酸溶液和原碱溶液的物质的量浓度: ;
原酸溶液和原碱溶液的物质的量浓度: ;⑼PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是: 。
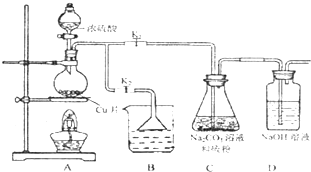 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:Na2S2O3在酸性溶液中不能稳定存在.
(1)某研究小组设计了制备Na2S203_5H20装置和部分操作步骤如图.
I.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
II.C中混合液被气流搅动,反应一段时间后,硫粉的域逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热.
III.过滤C中的混合液.
IV.将滤液经过
①II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是
②IV中,操作步骤是
③装置B中盛放的试剂是(填化学式)
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因
(2)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO
2- 4 |
2- 7 |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
①Cr2O
2- 7 |
②I2+2S2O
2- 3 |
2- 6 |
则判断达到滴定终点的现象是