网址:http://m.1010jiajiao.com/timu3_id_368280[举报]
| |||||||||||||||||||||||||||
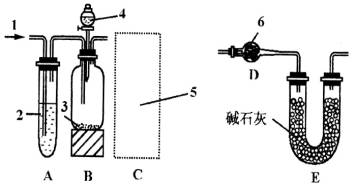
图中:1.空气;2.某溶液;3.纯碱;4.稀H2S04;6.碱石灰
实验步骤是:a.按下图所示仪器,组装好实验装置,并检查其气密性;b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g);c.准确称量一定量的纯碱(设为n g),并将其放进广口瓶内;d.从分液漏斗中缓缓滴人一定量的稀硫酸,并从“1”处缓缓鼓入空气,至B反应器中不再产生气体时为止;e.准确称量干燥管D的总质量(设为m2 g)。根据上述实验,回答下列问题:
(1)该实验进行至操作d时,要缓缓鼓人空气,鼓入空气的作用是________。装置A中盛装的液体“2”应选用________。装置A的作用是________。如果撤去装置A,直接向装置B中缓缓鼓人空气,则会导致实验测定结果________(填“偏大”、“偏小”或“不变”)。
(2)在空白格内画出装置C及试剂。装置C盛放的试剂“5”是________。装置C的作用是________;如果撤去装置C,则会导致实验测定结果________(填“偏大”、 “偏小”或“不变”。)
(3)根据此实验,计算纯碱中Na2CO3的质量分数的数学式为________。(用m1,m2,n表示)
(4)装置E的作用是________。
查看习题详情和答案>>
海洋中含有丰富的资源,是人类的巨大宝库。我国拥有很长的海岸线,东部沿岸海滩平缓,多细沙,日照时间长,不少盐场均集中于此。回答下列问题:
(1)制海盐方法如下:海水涨潮时,将海水引入盐田,等落潮时,再用日晒的方法,待盐田水分蒸发到一定程度时,撒入食盐颗粒(称为晶种),食盐晶体即从饱和溶液中析出。请说明盐田获得食盐晶体的条件:_____。
(2)以食盐为主要原料可以制备纯碱。试用化学方程式表示其制备过程:______、_____。此法制得的纯碱中常含有少量氯化钠,要测定样品中的纯碱的质量分数,还可利用如图装置进行实验:

(3)氯碱化工厂制得的烧碱中也含有少量氯化钠(假设不含其他杂质),用中和滴定法设计一个实验方案以测定样品中烧碱和氯化钠的质量分数。试剂是0.1000mol/L盐酸、酚酞溶液,仪器是50mL的酸式滴定管、锥形瓶。其实验的主要步骤是_______、_______、滴定。
(4)工业上用电解法制备金属钠,但制备金属钾一般不采用电解熔融氯化钾,而是采用热还原法来制备。在850℃用金属钠来还原KCl,反应如下:Na(l)+KCl(l)
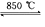 NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________
NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________ 纯碱中常含有少量的NaCl杂质,可利用下图的仪器装置测量纯碱中Na2CO3的质量分数.实验步骤是:a.按图中所示仪器组装实验装置,检查气密性;b.准确称量盛有碱石灰的U型管D的质量(![]() );c.准确称取一定量的纯碱(n g)并放入B中的广口瓶;d.从分液漏斗中缓缓滴入一定量的稀H2SO4,并从“I”处缓缓鼓入空气,至B中不再产生气体为止;e.标准称量U型管D的总质量(
);c.准确称取一定量的纯碱(n g)并放入B中的广口瓶;d.从分液漏斗中缓缓滴入一定量的稀H2SO4,并从“I”处缓缓鼓入空气,至B中不再产生气体为止;e.标准称量U型管D的总质量(![]() ).回答下列问题.
).回答下列问题.

(1)实验操作d要鼓入空气的作用是________.A的作用是________.若没有A,直接向B中鼓入空气,会导致实验测定结果(填“偏大”、“偏小”或“不变”)________.
(2)C中浓H2SO4的作用是________.
(3)列出计算纯碱样品中Na2CO3的质量分数的数学表达式(用![]() 、
、![]() 、n表示)________.
、n表示)________.
(4)E的作用是___________________________________________________
查看习题详情和答案>>

(1)实验操作d要鼓入空气的作用是________.A的作用是________.若没有A,直接向B中鼓入空气,会导致实验测定结果(填“偏大”、“偏小”或“不变”)________.
(2)C中浓H2SO4的作用是________.
(3)列出计算纯碱样品中Na2CO3的质量分数的数学表达式(用![]() 、
、![]() 、n表示)________.
、n表示)________.
(4)E的作用是___________________________________________________
查看习题详情和答案>>
