摘要:23.W.A.Y.Z四种短周期元素的原子序数A>W>Z>Y.W原子最外层电子数不超过最内层电子数.A原子L层电子数是其他各层电子总数的2倍.Y原子形成的气态氢化物分子与形成的最高价氧化物分子的电子数之比为5∶11.Z是自然界中含量最多的元素. (1)W在周期表中处于第 周期 族. (2)Y元素可形成化学式为Y60的物质.该物质称为足球烯.已知该物质溶于有机溶剂.熔 点较低.由此可推测Y60晶体属于 晶体.Y原子间形成 键. (3)Y和Z形成的化合物与W和Z形成的化合物反应.其化学方程式可能是: , . (4)这四种元素原子半径的大小为 > > > .
网址:http://m.1010jiajiao.com/timu3_id_368275[举报]
| |||||||||||||||||||
 W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族.请回答下列问题.
W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族.请回答下列问题.(1)W的原子结构示意图为


酸性强弱为HClO4>H3PO4
酸性强弱为HClO4>H3PO4
(举一例).(2)W、Y和氢3种元素所形成的一种化合物,其75%(体积分数)的溶液常用于医疗消毒,该化合物的结构简式为
CH3CH2OH
CH3CH2OH
.(3)电解NaZ水溶液时,阴极的电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
.工业上,以上述反应的阳极产物和Ca(OH)2为原料,制备漂白粉反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.(4)已知:298K时,金属钠与Y2气体反应,生成1mol Na2Y固体时,放出热量414kJ;生成1mol Na2Y2固体时,放出热量511kJ.由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为
Na2O(s)+
O2(g)=Na2O2(s);△H=-97kJ/mol
| 1 |
| 2 |
Na2O(s)+
O2(g)=Na2O2(s);△H=-97kJ/mol
.| 1 |
| 2 |
W、X、Y、Z四种短周期元素在元素周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数l:1和1:2的化合物.
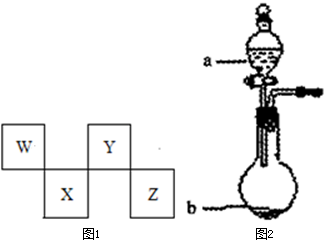
请回答下列问题.
(1)W元素形成的同素异形体的晶体类型可能是(填序号) .
①原子晶体 ②离子晶体③分子晶体 ④金属晶体
(2)H2Y2的电子式为 ,Na2Y2中的化学键种类为: .
(3)在图2中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成.当消耗2molI-时,共转移3mol电子,该反应的离子方程式是 .
(4)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1mol Na2Y2固体时,放出热量511kJ.则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为 .
(5)X的原子结构示意图为 .Z在周期表中的位置 .
(6)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能.假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入Z2的电极为原电池的 极,其电极反应式为 .
查看习题详情和答案>>

请回答下列问题.
(1)W元素形成的同素异形体的晶体类型可能是(填序号)
①原子晶体 ②离子晶体③分子晶体 ④金属晶体
(2)H2Y2的电子式为
(3)在图2中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成.当消耗2molI-时,共转移3mol电子,该反应的离子方程式是
(4)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1mol Na2Y2固体时,放出热量511kJ.则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为
(5)X的原子结构示意图为
(6)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能.假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入Z2的电极为原电池的
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A、X、Y、Z中最简单氢化物稳定性最弱的是Y | B、Z元素氧化物对应水化物的酸性一定强于Y | C、X元素形成的单核阴离子还原性大于Y | D、Z元素单质在化学反应中只表现氧化性 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,下列判断不正确的是( )
| W | X | |
| Y | Z |
| A、原子半径大小:W>X |
| B、元素最高正价:W>Z |
| C、简单阴离子的还原性:Y>Z |
| D、气态氢化物的稳定性:X>Y |