摘要:日本右冀势力修改历史教科书说明了: ①.经济.政治决定文化.文化又反作用于经济.政治.并给予经济政治以巨大的影响 ②.文化潜移默化地对人们的交往行为.交往方式.实践活动.认识活动和思维方式等.产生深远持久的影响. ③.日本具有强大的经济实力.国内政治上存在着强大的右翼势力.这决定了它要谋求政治霸权和文化霸权.日本右翼势力修改历史教科书.是谋求文化霸权的表现.其目的是美化侵略历史.向青少年灌输军国主义思想.最终使日本成为政治和军事大国. ④.非意识形态性质的文化决定经济政治的发展 A.①②③ B.①④ C.①②③④ D.①②
网址:http://m.1010jiajiao.com/timu3_id_36436[举报]
(2009?安徽模拟)某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有

查看习题详情和答案>>
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):
分别取钠、镁、铝小粒分别与冷水反应,钠剧烈反应,镁和铝无明显现象;另取镁、铝小粒分别与等浓度的盐酸反应,镁比铝反应剧烈
分别取钠、镁、铝小粒分别与冷水反应,钠剧烈反应,镁和铝无明显现象;另取镁、铝小粒分别与等浓度的盐酸反应,镁比铝反应剧烈
.(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的
能
能
(填“能”或“不能”),设计的理论依据是元素的非金属性越强,其最高价氧化物的水合物酸性越强
元素的非金属性越强,其最高价氧化物的水合物酸性越强
. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见在两导管之间连接一个装有饱和碳酸钠的洗气瓶
在两导管之间连接一个装有饱和碳酸钠的洗气瓶
.(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与
铝
铝
相似的性质,能证明其预测的实验方案是铍单质分别与酸和强碱反应,看反应现象
铍单质分别与酸和强碱反应,看反应现象
.(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有
A:白色变成黄色或橙黄色;B:变蓝色;C:红纸褪色
A:白色变成黄色或橙黄色;B:变蓝色;C:红纸褪色
. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议尾气排入空气污染环境,应在试管口处放一团浸有氢氧化钠溶液的棉花
尾气排入空气污染环境,应在试管口处放一团浸有氢氧化钠溶液的棉花
.
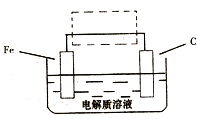 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe304+4CO
| ||
8
8
mol;(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
因酸性废液中,将会Fe3+抑制的水解,无法得到Fe(OH)3胶体,故不能够吸附悬
因酸性废液中,将会Fe3+抑制的水解,无法得到Fe(OH)3胶体,故不能够吸附悬
;(3)钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向


(4)硫酸亚铁晶体(FeS04?7H20)常作医药上的补血剂.课外研究性小组测定该补血剂中铁元素的含量.实验步骤如下:
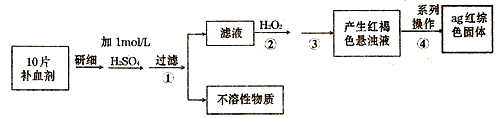
请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加H2O2,此过程的现象为:
H2O2溶液由浅绿色变为血红色
H2O2溶液由浅绿色变为血红色
;②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH=
3.3
3.3
(已知溶液中离子浓度小于10-5mol时,该离子可看做沉淀完全;lg2=0.3);③步骤④中一系列的操作步骤为:过滤、
洗涤
洗涤
、灼烧、冷却、称量;④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质量为
0.07a
0.07a
g.(用含a的式子表示)铁、铜及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2,其中S为-1价)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2
6SO2+Fe3O4,氧化产物为
(2)与明矾相似,硫酸铁也可用作净水剂.某自来水厂用氯气和绿矾 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为
(3)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在右图虚线框内作出修改,并用箭头标出电子流动方向.
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式
(4)高铁酸钾(K2FeO4)可用作净水剂,也可用于制造高铁电池.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
该电池放电时正极反应式为
用该电池电解100mL 1mol?L-1的AgNO3溶液,当电路中通过0.1mol 电子时,被电解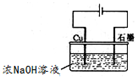 溶液的pH为
溶液的pH为
(5)氧化亚铜是一种半导体材料,常用作制造整流器的材料,还可以用于光照条件下水分解的催化剂和农作物的杀菌剂.
用右图装置可制得氧化亚铜,试写出阳极的电极反应式
查看习题详情和答案>>
(1)黄铁矿(FeS2,其中S为-1价)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2
| ||
SO2、Fe3O4
SO2、Fe3O4
,若有3mol FeS2参加反应,转移电子的物质的量为32mol
32mol
.(2)与明矾相似,硫酸铁也可用作净水剂.某自来水厂用氯气和绿矾
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为Cl2+2Fe2+=2Fe3++2Cl-
Fe3++3H2O?Fe(OH)3(胶体)+3H+
Fe3++3H2O?Fe(OH)3(胶体)+3H+
Cl2+2Fe2+=2Fe3++2Cl-
Fe3++3H2O?Fe(OH)3(胶体)+3H+
(用离子方程式表示).Fe3++3H2O?Fe(OH)3(胶体)+3H+
(3)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在右图虚线框内作出修改,并用箭头标出电子流动方向.
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式
O2+2H2O+4e-=4OH-,
O2+2H2O+4e-=4OH-,
.(4)高铁酸钾(K2FeO4)可用作净水剂,也可用于制造高铁电池.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为
3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH该电池放电时正极反应式为
2FeO42-+8H2O+6e-=2Fe(OH)3+10OH-
2FeO42-+8H2O+6e-=2Fe(OH)3+10OH-
.用该电池电解100mL 1mol?L-1的AgNO3溶液,当电路中通过0.1mol 电子时,被电解
 溶液的pH为
溶液的pH为0
0
(溶液体积变化忽略不计).(5)氧化亚铜是一种半导体材料,常用作制造整流器的材料,还可以用于光照条件下水分解的催化剂和农作物的杀菌剂.
用右图装置可制得氧化亚铜,试写出阳极的电极反应式
2Cu-2e-+2OH-=Cu2O+H2O
2Cu-2e-+2OH-=Cu2O+H2O
.日本东京地方法院2002年10月11日以杀人罪判处邪教组织奥姆真理教骨干远藤诚一死刑.其因为参与制造1995年袭击东京地铁的沙林毒气而获罪.1995年3月20日,日本东京地铁发生震惊世界的“沙林”毒气袭击事件,造成11人死亡,5500多人受伤,恐怖分子使用的“沙林”是剧毒的神经毒剂,其化学名称为甲氟磷酸异丙酯.已知甲氟磷酸的结构式为 ,则“沙林”的结构简式是( )
,则“沙林”的结构简式是( )
 ,则“沙林”的结构简式是( )
,则“沙林”的结构简式是( )
查看习题详情和答案>>
 (2010?潍坊一模)研究化学反应原理对于生产生活是很有意义的.
(2010?潍坊一模)研究化学反应原理对于生产生活是很有意义的.(1)下列关于醋酸的叙述正确的是
abd
abd
(填写符号).a.醋酸俗名冰醋酸,是食醋的主要成分
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度减小
(2)牙釉质对牙齿起着保护作用,其主要成分为Ca5(PO4)3OH,该物质在水中存在沉淀溶解平衡,试写出该物质的溶度积常数表达式Kap=
c(Ca2+)5c(PO43-)3c(OH-)
c(Ca2+)5c(PO43-)3c(OH-)
.(3)钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:
①写出石墨电极的电极反应式
O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
;②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向.
③写出修改后石墨电极的电极反应式
2Cl-2e-=Cl2↑
2Cl-2e-=Cl2↑
.