摘要:29.⑴ Cu ⑵ 与水和氧气接触 3CO + Fe2O3 高温 2Fe + 3CO2 ⑶ Fe .Cu .Ag Fe + 2HCl FeCl2 + H2↑ Fe(NO3)2
网址:http://m.1010jiajiao.com/timu3_id_30428[举报]
早在春秋战国时期,我国就开始生产和使用铁器.
(1)请写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式
A.耐腐蚀性 B.延展性 C.导热性 D.导电性
(2)铝比铁活泼,但铝箔比铁螺丝钉耐腐蚀,铝制品耐腐蚀的原因是
(3)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是
(4)设计从废水中回收硫酸亚铁固体和铜的实验方案如下:
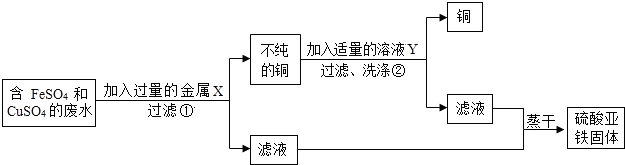
金属X是
查看习题详情和答案>>
(1)请写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
,盛水的铁锅与水面接触的一圈最易生锈.钢铁生锈的条件是
| ||
和氧气、水蒸气同时接触
和氧气、水蒸气同时接触
,利用新技术能将不锈钢加工成柔软的金属丝,这是利用了不锈钢的B
B
(填字母).A.耐腐蚀性 B.延展性 C.导热性 D.导电性
(2)铝比铁活泼,但铝箔比铁螺丝钉耐腐蚀,铝制品耐腐蚀的原因是
铝能和空气中的氧气反应产生一层致密的氧化膜
铝能和空气中的氧气反应产生一层致密的氧化膜
.(3)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是
氯化铝、氯化铜或硫酸铝、硫酸铜
氯化铝、氯化铜或硫酸铝、硫酸铜
.(4)设计从废水中回收硫酸亚铁固体和铜的实验方案如下:

金属X是
铁
铁
,写出上述实验方案中有关反应的化学方程式:①Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
;②Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.(2013?昌平区一模)金属在生活和生产中有广泛的应用.
(1)下列金属制品中,利用金属导热性的是

(2)铁生锈的条件是
(3)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为
(4)工业上生产电路板及处理废液的工艺流程如下:

Ⅰ.步骤①反应的化学方程式为
Ⅱ.步骤②得到滤渣的成分是
查看习题详情和答案>>
(1)下列金属制品中,利用金属导热性的是
B
B
(填字母序号).
(2)铁生锈的条件是
与水和氧气同时接触
与水和氧气同时接触
.(3)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(4)工业上生产电路板及处理废液的工艺流程如下:

Ⅰ.步骤①反应的化学方程式为
2FeCl3+Cu=2FeCl2+CuCl2
2FeCl3+Cu=2FeCl2+CuCl2
.Ⅱ.步骤②得到滤渣的成分是
Fe和Cu
Fe和Cu
.(2013?红桥区一模)Ag、Cu、Fe和Al是生产或生活中广泛使用的金属.
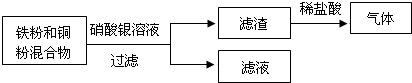
(1)四种金属中,不是银白色的是
(2)铁制品容易锈蚀,铁生锈的条件是
(3)根据图所示回答:滤渣中一定有的金属是
查看习题详情和答案>>

(1)四种金属中,不是银白色的是
Cu
Cu
.(2)铁制品容易锈蚀,铁生锈的条件是
与水和氧气接触
与水和氧气接触
.生锈的废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(3)根据图所示回答:滤渣中一定有的金属是
Fe、Cu、Ag
Fe、Cu、Ag
,滤渣与稀盐酸反应的化学方程式为Fe+2HCl═FeCl2+H2↑
Fe+2HCl═FeCl2+H2↑
;滤液中的溶质是Fe(NO3)2
Fe(NO3)2
.金属在生产和生活中应用广泛.
(1)每年因金属锈蚀造成很大浪费,铁生锈的条件是
(2)兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液.他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:
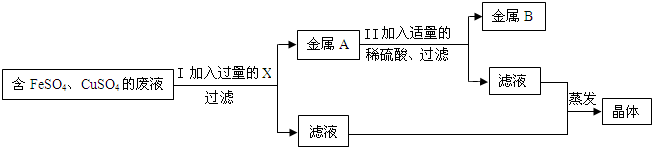
①写出Ⅰ中有关反应的化学方程式
②小红、小强同学在步骤Ⅰ中X能否改用锌的问题上产生了分歧.请你也参与他们的讨论,表明观点,并说明理由.
查看习题详情和答案>>
(1)每年因金属锈蚀造成很大浪费,铁生锈的条件是
与氧气、水同时接触
与氧气、水同时接触
;废钢铁可回收重新冶炼,高炉炼铁中一氧化碳还原氧化铁的化学方程式为3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(2)兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液.他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:

①写出Ⅰ中有关反应的化学方程式
Fe+CuSO4 ═FeSO4 +Cu
Fe+CuSO4 ═FeSO4 +Cu
.②小红、小强同学在步骤Ⅰ中X能否改用锌的问题上产生了分歧.请你也参与他们的讨论,表明观点,并说明理由.
不能用锌;锌能够将硫酸亚铁、硫酸铜分别转化为铁、铜,生成了ZnSO4杂质
不能用锌;锌能够将硫酸亚铁、硫酸铜分别转化为铁、铜,生成了ZnSO4杂质
.(2013?保山)金属的发展和应用,推动了社会的进步.根据金属的相关知识.回答下列问题.
(1)下列金属制品中,利用金属导电性的是

(2)工业上用一氧化碳和赤铁矿(主要成分是三氧化二铁)冶炼铁的化学反应方程式为
(3)硬币制造设计到的金属有:Fe、Cu、Al、Ni(镍)等.已知Ni能够发生如下反应:
Ni+H2SO4═NiSO4+H2↑ Fe+NiCl2═Ni+FeCl2
这两个反应都属于基本反应类型中的
(4)据报道,金属材料因锈蚀而报废相当于世界年产量的
左右.铁生锈的条件是
查看习题详情和答案>>
(1)下列金属制品中,利用金属导电性的是
C
C
(填序号).
(2)工业上用一氧化碳和赤铁矿(主要成分是三氧化二铁)冶炼铁的化学反应方程式为
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(3)硬币制造设计到的金属有:Fe、Cu、Al、Ni(镍)等.已知Ni能够发生如下反应:
Ni+H2SO4═NiSO4+H2↑ Fe+NiCl2═Ni+FeCl2
这两个反应都属于基本反应类型中的
置换反应
置换反应
,Fe、Cu、Al、Ni的活动性由强到弱的顺序是Al>Fe>Ni>Cu
Al>Fe>Ni>Cu
(用元素符合表示).(4)据报道,金属材料因锈蚀而报废相当于世界年产量的
| 1 |
| 3 |
铁与空气中的水、氧气共同接触
铁与空气中的水、氧气共同接触
;根据铁锈蚀的条件,写出一种防止铁制品锈蚀的具体方法在铁表面涂一层油漆
在铁表面涂一层油漆
.