摘要:1.实验室制氧气 (1)在实验室里可用 溶液来制取氧气 ①原理: 过氧化氢 + 实验探究二氧化锰的作用: 实验编号 实验步骤 实验现象 实验结论 Ⅰ 在试管中加入5 mL 5%的过氧化氢溶液.用带火星的木条伸入试管中 不复燃 在常温下过氧化氢溶液分解很慢 Ⅱ 加热上述试管.用带火星的木条伸入试管中 有气泡冒出.木条复燃 温度升高.过氧化氢分解速率加快 Ⅲ 在另一支试管中加入5 mL 5%的过氧化氢溶液.并加入少量二氧化锰.用带火星的木条伸入试管中 木条复燃 二氧化锰使过氧化氢分解速率加快 若在实验前准确称出二氧化锰的质量.实验后将二氧化锰回收.干燥.再称量.会发现它的质量 改变. 结论:二氧化锰可使过氧化氢溶液在常温下迅速分解.作催化剂. 催化剂:在化学反应中能改变反应速率.但本身的 和 在反应前后都没有发生变化的物质. ②实验装置: Ⅰ.发生装置的选择:由于过氧化氢是 .二氧化锰是 .且反应不需要 .故采用锥形瓶作为反应容器.配双孔胶塞.一孔插入分液漏斗.另一孔插入导管. Ⅱ.收集装置的选择:由于氧气不易溶于水且不和水反应.故要制取较纯净的气体.需采用 法.又由于氧气的密度比空气的平均密度大.故要制取较干燥的气体时.需采用排 空气法. 图2-8 ③检验方法: 将带火星的木条伸入集气瓶中.如果.说明该瓶内的气体是氧气. ④验满方法: Ⅰ.用排水法收集时.当气泡从 冒出时.说明该瓶内的气体已满. Ⅱ.用向上排空气法收集时.将带火星的木条放在 处.如果木条复燃.说明该瓶内的气体已满. ⑤实验步骤: Ⅰ.检查装置的 , Ⅱ.加药品, Ⅲ.组装装置, Ⅳ.收集氧气. (2)在实验室中也可以用高锰酸钾来制取氧气 ①原理:高锰酸钾 + +氧气 ②实验装置: 图2-9 ③实验室用高锰酸钾制取氧气并用排水法收集的步骤. 实验室用高锰酸钾制取氧气并用排水法收集.其步骤可总结为“三先三后 (即先检查装置 .后装入 .先预热.后集中在药品的部位加热,先将导管从 .后熄灭酒精灯).也可缩记为:“查 “装 “定 “点 “收 “离 “熄 再利用谐音来理解记忆为:茶荘定点收利息. 答案:(1)①过氧化氢 水 氧气 没有 质量 化学性质 ②液体 固体 加热 排水 向上 ③木条复燃 ④集气瓶外 集气瓶口 ⑤气密性 (2)①锰酸钾 二氧化锰 ③气密性 药品 水槽中取出
网址:http://m.1010jiajiao.com/timu3_id_28556[举报]
在实验室里可用
查看习题详情和答案>>
分解过氧化氢溶液
分解过氧化氢溶液
或加热氯酸钾
加热氯酸钾
来制取氧气.当用过氧化氢溶液
过氧化氢溶液
制取氧气时,通常加入二氧化锰,这时,二氧化锰起催化
催化
作用,反应完毕后,当把二氧化锰分离出来,发现此时的二氧化锰的质量
质量
和化学性质
化学性质
没有发生变化.在试验室里可用______溶液来制取氧气
1.用过氧化氢制氧气
(1)原理:(用文字表达式来表示)
过氧化氢![]() ______+______
______+______
实验探究二氧化锰的作用:
| 实验编号 | 实验步骤 | 实验现象 | 实验结论 |
| Ⅰ | 在试管中加入5 mL 5%的过氧化氢溶液,用带火星的木条伸入试管中 | 不复燃 | 在常温下过氧化氢溶液分解很慢 |
| Ⅱ | 加热上述试管,用带火星的木条伸入试管中 | 有气泡冒出,木条复燃 | 温度升高,过氧化氢分解速度加快 |
| Ⅲ | 在另一只试管中加入5 mL 5%的过氧化氢溶液,并加入少量二氧化锰,用带火星的木条伸入试管中 | 木条复燃 | 二氧化锰使过氧化氢分解速度加快 |
若在实验前准确称出二氧化锰的质量,试验后将二氧化锰回收、干燥、再称量,会发现它的质量改变_______。
结论:二氧化锰可使过氧化氢溶液在常温下迅速分解,作催化剂。
催化剂:在化学反应中能改变反应速率,但本身的______和______在反应前后都没有发生变化的物质。
查看习题详情和答案>>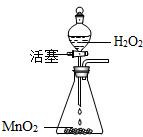 在实验室里,常采用分解过氧化氢溶液(二氧化锰作催化剂)的方法制取氧气(如图所示)
在实验室里,常采用分解过氧化氢溶液(二氧化锰作催化剂)的方法制取氧气(如图所示)(1)请写出该反应的化学方程式
(2)如果锥形瓶中的反应过于剧烈,应该采取的措施是
(3)利用该装置还可以制备的一种气体是
在实验室里,常采用分解过氧化氢溶液、加热氯酸钾或加热高锰酸钾的方法制取氧气.下图是实验室制取氧气的常用装置:

(1)写出仪器名称:① ;② ;③ ;④ .
(2)如果利用高锰酸钾制取氧气时,气体的发生装置应选择 ;该反应的文字表达式是: .加热时,试管口还要放一团棉花,目的是 ;在收集气体时,为收集到更为纯净的气体,应等 才能开始收集.
(3)如果利用过氧化氢溶液制取氧气时,在试管中除加入过氧化氢溶液外,还应加入的固体药品是 ,气体的发生装置应选择 ,所发生化学反应的文字表达式是: ;
(4)实验室用加热高锰酸钾制取氧气,并用排水法收集时,实验结束时发现装药品的试管破裂了,其可能原因是(写一条) .
查看习题详情和答案>>

(1)写出仪器名称:①
(2)如果利用高锰酸钾制取氧气时,气体的发生装置应选择
(3)如果利用过氧化氢溶液制取氧气时,在试管中除加入过氧化氢溶液外,还应加入的固体药品是
(4)实验室用加热高锰酸钾制取氧气,并用排水法收集时,实验结束时发现装药品的试管破裂了,其可能原因是(写一条)
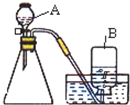 在实验室里,常用分解过氧化氢溶液、加热氯酸钾或高锰酸钾制取氧气.某化学兴趣小组对氧气的实验室制法进行了探究.
在实验室里,常用分解过氧化氢溶液、加热氯酸钾或高锰酸钾制取氧气.某化学兴趣小组对氧气的实验室制法进行了探究.(1)小明同学选用如图所示的装置制取氧气.制取过程中所发生的化学反应表达式为:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.实验过程中,证明集气瓶收集满氧气的现象是
| ||
集气瓶口有气泡溢出
集气瓶口有气泡溢出
.(2)小红同学通过互联网得知:CuSO4溶液、动物某些脏器中含有的物质等能催化过氧化氢的分解.实验证明,在过氧化氢溶液中滴加CuSO4溶液能显著加快过氧化氢的分解.CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),为了进一步探究CuSO4溶液中哪种粒子能起催化作用.小红同学作了以下分析和设计.
①小红同学认为最不可能的是H2O,他的理由是
过氧化氢的溶液中中的溶剂是水,因此H2O不能起催化作用
过氧化氢的溶液中中的溶剂是水,因此H2O不能起催化作用
.②要说明另外的两种粒子是否起到催化作用,小红同学设计了如下实验,完成了这次探究活动.
| 实验步骤 | 实验现象 | 结论 |
| a.取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴稀硫酸(含SO42-) | 溶液几乎没有气泡放出 | 实验证明,起催化作用的是 Cu2+ Cu2+ . |
| b.另取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴 硫酸铜 硫酸铜 溶液 |
溶液中有大量气泡放出 |
质量和化学性质不发生改变
质量和化学性质不发生改变
.