网址:http://m.1010jiajiao.com/timu3_id_146497[举报]
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤______________________________。
⑥______________________________。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:
______________________________。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:______________________________。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,
Fe(OH)3的Ksp=2.64×10-39)。下列说法正确的是______________(选填序号)。

b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钢,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_________________________。
(5)补充上述步骤⑤和⑥【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】。
⑤_________________________
⑥_________________________
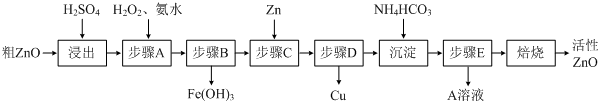
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
(1)步骤A加H2O2发生反应的离子方程式是
(2)A溶液中主要含有的溶质是
(3)若经处理后的废水pH=8,此时Zn2+的浓度为
(4)步骤C中加Zn的目的是
铜、铁、锌等金属混合而成的合金W g,加入FeCl3和盐酸的混合液中(Fe3+能氧化:Cu![]() Cu2+、Fe
Cu2+、Fe![]() Fe2+、Zn
Fe2+、Zn![]() Zn2+,本身被还原为Fe2+即Fe3+
Zn2+,本身被还原为Fe2+即Fe3+![]() Fe2+),充分反应后:
Fe2+),充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有________,可能还有________。
(2)若剩余固体为![]() g,则溶液中的阳离子一定有________,可能还有________,一定没有________。
g,则溶液中的阳离子一定有________,可能还有________,一定没有________。
(3)若剩余固体为![]() g,则溶液中的阳离子一定有________,一定没有________。
g,则溶液中的阳离子一定有________,一定没有________。
提示:①Fe3+氧化性>H+ ②失电子能力Zn>Fe>Cu
(1)Cu2+、Fe2+、Zn2+ Fe3+、H+
(2)Zn2+、Fe2+ H+、Fe3+ Cu2+
(3)Zn2+、Fe2+ Cu2+、Fe3+、H+
18.已知PbSO4难溶于水,难溶于稀HNO3,但可溶于CH3COONa或CH3COONH4溶液,PbSO4+CH3COONH4====(CH3COO)2Pb+(NH4)2SO4
又(CH3COO)2Pb中通入H2S气体又可得黑色沉淀PbS,写出有关离子方程式:
(1)Pb(NO3)2+Na2SO4====PbSO4↓+2NaNO3___________________________。
(2)PbSO4+2CH3COONa==== (CH3COO)2Pb+Na2SO4___________________________。
(3)(CH3COO)2Pb+H2S====PbS↓+2CH3COOH___________________________。
查看习题详情和答案>>废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
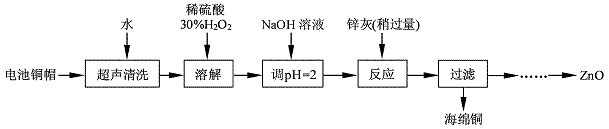
(1)①铜帽溶解时加入H2O2 的目的是 (用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的H2O2 除去。除去H2O2 的简便方法是 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O32- +I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②若滴定前溶液中的H2O2 没有除尽,所测定的Cu2+含量将会 (填“偏高”、“偏低”或“不变”)。
(3)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Zn2+ | 5. 9 | 8. 9 |
实验中可选用的试剂:30%H2O2、1. 0 mol·L-1HNO3、1. 0 mol·L-1NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:① ;② ;③过滤;④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看习题详情和答案>>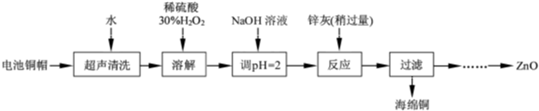
(1)①铜帽溶解时加入H2O2 的目的是
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为
②若滴定前溶液中的H2O2 没有除尽,所测定的Cu2+含量将会
(3)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol?L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
①