网址:http://m.1010jiajiao.com/timu3_id_145750[举报]
一、实验用品:纯锌片,铜片,37%的浓盐酸,蒸馏水,氯化铜溶液。
二、实验记录:
交流卡片 NO:2006—SY—518 主题:Zn,Cu与浓盐酸 A.将锌放入浓盐酸中,反应较快 B.将锌片与铜片贴在一起,一同投入浓盐酸中,反应快速放出气体 C.当B中锌片完全溶解后,将溶液加热,又产生气体(值得进一步探究),得到无色溶液 D.将上述反应后的溶液,隔绝空气,加入适量水,出现白色沉淀 |
三、提供资料:
资料卡片 NO:2006—ZL—918 主题:生成一价铜的反应 ①课本上:CH3CHO+2Cu(OH)2 ②盐城市第二次调研试卷:Cu2++4I-====2CuI(白色)↓+I2 ③《无机化学》下册,p788,氯化亚铜在不同浓度的KCl溶液中可形成[CuCl2]-、[CuCl3]2-、[CuCl4]3-等离子,且它们在溶液中均为无色。 |
四、请你参与以下探究:
(1)交流卡片中,实验A反应速率明显比B小,原因是:___________________________。
(2)根据铜位于金属活动顺序表氢之后,与稀盐酸不反应,依据交流卡片C又产生气体的事实。作出如下推断:
①有同学认为是溶解在溶液中的H2逸出,你认为是否有道理,理由是:__________________。
②某同学作了如下猜想,是否成立,请你设计实验方案加以验证:
猜想 | 验证方法 | 预测现象及结论 |
认为铜片中可能含有锌等杂质 |
|
|
(3)交流卡片D中的白色沉淀,分析:不可能是CuCl2,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液更稀,不会产生出沉淀。并利用资料①②大胆猜想,白色沉淀是生成的氯化亚铜。请你帮他设计验证方案(若有多个,只设计两个方案):
| 预设验证方法 | 预测的现象与结论 |
白色沉淀是氯化亚铜 |
|
|
|
|
(4)指导老师肯定了白色沉淀是氯化亚铜,请结合资料卡片③,写出铜与足量盐酸在加热条件下反应生成无色溶液及气体的化学方程式:___________________。根据交流卡片D,生成沉淀,实际上是一个平衡问题,请写出这一平衡关系式:___________________(用离子方程式表示)。
(5)就铜与浓盐酸反应若还需进一步探讨,你认为还可探究的内容有:___________________(只提供一个实验课题即可)。
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:

背影资料:

请你参与以下探究:
(1)实验A反应速度明显比B小,原因是
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证.
| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 |
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | ||
有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如下图所示。
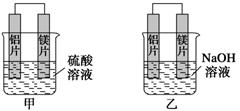
(1)写出甲池中正极的电极反应式:
正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极:________________________________________________________________。
总反应的离子方程式:______________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?( )
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________________________________________________________________________________________________________________________(如可靠,此空可不填)。
查看习题详情和答案>>
(8分)有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝
片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1
的NaOH溶液中,如下图所示。
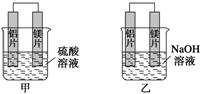
(1)写出甲池中正极的电极反应式:
正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极:________________________________________________________________。
(3)甲同学又将硫酸溶液换为浓硝酸发现有红棕色气体产生,则原电池的正极的电极反应式为
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些正确结论?( )
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_________________________________________________________________(如可靠,此空可不填)。
查看习题详情和答案>>
(14分)
Ⅰ.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入2 mol/L H2SO4溶液中,乙同学将电极放入2 mol/L的NaOH溶液中,如图:

(1)写出甲池中正极的电极反应式: ;
(2)写出乙池中负极的电极反应式: ;
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填元素符号)。
(4)由此实验,可得到如下哪些正确结论?( )
A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已设有实用价值
D.该实验说明化学研究对象复杂、化学反应受条件影响较大,因此应具体问题具体分析
Ⅱ.向一个容积为2 L的密闭容器中充入2 mol A和1
mol B,发生如下反应:2 A(g)
+ B(g)  xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
(1)x= ;
(2)若使容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为
(填“吸热”或“放热”)反应;
(3)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是 (用序号填空)
①4 mol A + 2 mol B
②3 mol C + 1 mol D
③3 mol C + 1 mol D +1 mol B
查看习题详情和答案>>