网址:http://m.1010jiajiao.com/timu3_id_144770[举报]
如右图是某学生设计的过滤操作示意图。

(1)写出有标号仪器的名称:A__________,B__________,C__________,D__________。图中有________处错误,说明改正方法:____________________________________________
_______________________________________________________________________________;
_______________________________________________________________________________;
_______________________________________________________________________________。
(2)该学生在过滤操作实验时,发现经过滤的液体仍然有浑浊现象,请你帮他找出造成此现象的两种可能的原因。
查看习题详情和答案>>如右图是某学生设计的过滤操作示意图。

(1)写出有标号仪器的名称:A__________,B__________,C__________,D__________。图中有________处错误,说明改正方法:____________________________________________
_______________________________________________________________________________;
_______________________________________________________________________________;
_______________________________________________________________________________。
(2)该学生在过滤操作实验时,发现经过滤的液体仍然有浑浊现象,请你帮他找出造成此现象的两种可能的原因。
查看习题详情和答案>>如右图是某学生设计的过滤操作示意图。

(1)写出有标号仪器的名称:A__________,B__________,C__________,D__________。图中有________处错误,说明改正方法:____________________________________________
______________________________________________________________________________;
______________________________________________________________________________;
______________________________________________________________________________。
(2)该学生在过滤操作实验时,发现经过滤的液体仍然有浑浊现象,请你帮他找出造成此现象的两种可能的原因。
查看习题详情和答案>>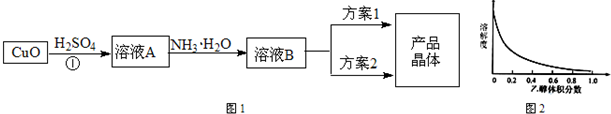
相关信息如下:
①溶液B为[Cu(NH3)4]SO4、(NH4)2SO4混合溶液;
②(NH4)2SO4在水中可溶,在乙醇中难溶;
③[Cu(NH3)4]SO4在乙醇水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图2;
④[Cu(NH3)4]SO4?H2O受热易失水分解,[Cu(NH3)4]SO4溶液受热易转化为Cu(OH)2或碱式硫酸铜[Cu2(OH)2SO4]沉淀;
请根据以上信息回答下列问题:
(1)请写①的化学反应方程式
(2)方案1的实验步骤为:
a.加热蒸发 b.冷却结晶 c.过滤 d.洗涤 e.干燥
该方案存在明显缺陷,因为得到的产物晶体中往往含有
(3)方案2的实验步骤为:
a.向溶液B加入适量
①请在上述空格内填写合适的试剂或操作名称.
②下列选项中,最适合作为步骤c的洗涤液
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是
查阅资料:
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵.
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示
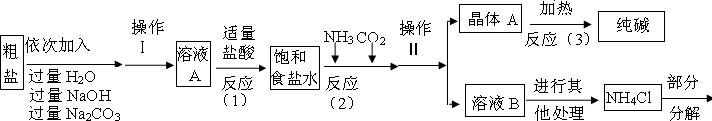
氯化铵分解的化学方程式是NH4Cl═NH3↑+HCl↑
<资料4>生产原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,分离的晶体A,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为
问题讨论:
(1)溶液A中的溶质为
(2)上述流程中氢氧化钠溶液的作用是
(3)上述生产流程中可循环使用的是
A.CO2 B.NH3 C.HCl D.NaOH E.Na2CO3
(4)上述反应(1)中发生了两个化学反应,写出反应的化学方程式:
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质
含量测定:
同学们为了测定该纯碱样品的纯度(假定只含一种上述杂质),设计了如下实验.
甲组:取12,0g纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出.将反应后所得溶液
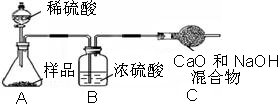 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为乙组:取12,0g纯碱样品,利用右图所示装置,测出反应后装置C增重了4.1g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是
丙组:取12.0克的纯碱样品,完全溶于水,向其中加入过量的氯化钙溶液,待完全沉淀后过滤、洗涤、烘干称量固体质量,从而计算碳酸钠的质量分数.组内同学提出意见,认为如果将氯化钙溶液换成氯化钡溶液则更好,老师认为有道理,原因是