摘要:13.右图是一个密封的容器.在其中装有棕色溴蒸气.当把活塞向内推时.看到的现象是 .说明了 . [拓展提高]
网址:http://m.1010jiajiao.com/timu3_id_141061[举报]
根据课本中测定空气中氧气含量实验回答下列问题:
(1)实验时,燃烧匙里红磷要过量,其目的是
(2)为了确保实验的成功,在装药品之前应该检查
(3)这个实验过程中,下图能正确表示广口瓶内气体体积变化情况的是

(4)如图1所示装置也能粗略地测定空气中氧气的体积分数,玻璃管中部有一可左右滑动的活塞,活塞左端管内密封有空气,活塞右端的玻璃管口跟空气连通,实验开始前活塞处在刻度5cm处,在白磷处微热,可观察到玻璃管内开始发生的现象:
(5)如图2是“空气中氧气体积分数测定”实验的改进装置.主要操作是:在实际容积为150mL的集气瓶里,先装进50mL的水,再按图连好仪器,按下热的玻璃棒,白磷立即被点燃.
①白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是
②集气瓶里预先装进的水,在实验过程中起到哪些作用?
a.加快集气瓶冷却 b.液封导气管末端以防气体逸出 c.缓冲集气瓶内气压的骤然升高.

查看习题详情和答案>>
(1)实验时,燃烧匙里红磷要过量,其目的是
全部消耗掉集气瓶内的氧气
全部消耗掉集气瓶内的氧气
(2)为了确保实验的成功,在装药品之前应该检查
装置的气密性
装置的气密性
(3)这个实验过程中,下图能正确表示广口瓶内气体体积变化情况的是
B
B

(4)如图1所示装置也能粗略地测定空气中氧气的体积分数,玻璃管中部有一可左右滑动的活塞,活塞左端管内密封有空气,活塞右端的玻璃管口跟空气连通,实验开始前活塞处在刻度5cm处,在白磷处微热,可观察到玻璃管内开始发生的现象:
白磷燃烧,产生大量白烟,活塞向右移动
白磷燃烧,产生大量白烟,活塞向右移动
,实验结束,恢复至常温后,活塞应停在约4
4
cm处,与课本上的装置相比,该装置的优点是操作简单,环保
操作简单,环保
(5)如图2是“空气中氧气体积分数测定”实验的改进装置.主要操作是:在实际容积为150mL的集气瓶里,先装进50mL的水,再按图连好仪器,按下热的玻璃棒,白磷立即被点燃.
①白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是
先下降,后上升
先下降,后上升
;若实验非常成功,最终集气瓶中水的体积约为70mL
70mL
.②集气瓶里预先装进的水,在实验过程中起到哪些作用?
abc
abc
(填写序号)a.加快集气瓶冷却 b.液封导气管末端以防气体逸出 c.缓冲集气瓶内气压的骤然升高.

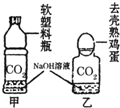 (2008?衡阳)实验室检验CO2通常用澄清石灰水,而吸收CO2通常用NaOH溶液,但CO2与NaOH溶液反应时无明显现象.振衡中学研究性学习小组就如何证明CO2与NaOH溶液确实发生了化学反应进行探究.
(2008?衡阳)实验室检验CO2通常用澄清石灰水,而吸收CO2通常用NaOH溶液,但CO2与NaOH溶液反应时无明显现象.振衡中学研究性学习小组就如何证明CO2与NaOH溶液确实发生了化学反应进行探究.(1)小明同学设计了如右图所示的甲、乙两个实验,并认为从观察到的实验现象可证明CO2与NaOH发生了反应,其实验现象为:甲:
软塑料瓶变瘪
软塑料瓶变瘪
,乙:“瓶吞鸡蛋”.这两个实验的共同原理是在密闭容器内NaOH溶液与CO2反应使瓶内压强减小
在密闭容器内NaOH溶液与CO2反应使瓶内压强减小
(2)小卫同学认为还必须做一个对比试验,才能真正说明问题,该对比实验是:
CO2在与甲或乙相同条件溶于水
CO2在与甲或乙相同条件溶于水
.(3)小丽同学利用与上述实验不同的原理,设计了如下两个实验方案,请你帮助完成:
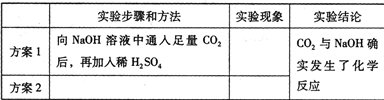
(4)由上述探究性学习,得到的启示是
ABCD
ABCD
(填字母代号).A.可以通过改变实验装置,创设新情境观察到明显的反应现象
B.可以通过检验生成物的存在,证明没有现象的化学反应确实发生
C.对比实验是学习化学,开展探究性学习的有效方法
D.由于NaOH能与CO2反应,所以NaOH应密封保存.
 15、某化学课外兴趣小组,开展了以下两项活动:
15、某化学课外兴趣小组,开展了以下两项活动:(1)第一组探究空气中氧气的含量.他们设计了如右图的装置,研究空气中所含氧气的体积,用一个50mL量筒倒扣在水中,使量筒内外液面均位于40mL处.量筒内浮着一个铜制的小船,船中放有足量白磷.现把浓硫酸缓缓倒入水中并搅拌.一会儿,白磷发生自燃,量筒内液面上升,向水槽内加水,至水槽与量筒内液面相平,读出读数.
①加入浓硫酸的的目的是
浓硫酸溶于水放热,使温度达到白磷的着火点以上
;②放白磷的小船用铜做的原因是
铜导热性好且化学性质稳定
;③最终,液面大约位于量筒刻度
32mL
处;④为何要向水槽内加水至内外液面相平
使气体内外压强相等,从而测得的气体体积更精确
;⑤试评价该兴趣小组的设计在选用仪器上有何缺陷
量筒不能用作反应容器
.(2)配制4%的氢氧化钠溶液200g,并用此溶液测定某硫酸溶液的溶质质量分数.
①配制200g质量分数为4%的氢氧化钠溶液,需要氢氧化钠固体的质量为
8
g,水的体积为192
mL(水的密度近似看作1g/cm3).②配制氢氧化钠溶液时,需要的玻璃仪器有量筒、烧杯、玻璃棒
及
胶头滴管
.配制好的氢氧化钠溶液要密封保存,其原因是:CO2+2NaOH=Na2CO3+H2O
(写化学方程式).③用配得的氢氧化钠溶液与待测溶质质量分数的硫酸溶液反应,
 实验过程中溶液的pH变化曲线如右图所示:
实验过程中溶液的pH变化曲线如右图所示:I、要得到此变化曲线,所进行的操作是
B
(填字母).A、将硫酸溶液滴加到氢氧化钠溶液中 B、将氢氧化钠溶液滴加到硫酸溶液中
II、b点对应的溶液中的溶质为
Na2SO4和NaOH
(写化学式).④恰好完全反应时,消耗20g氢氧化钠溶液和25g硫酸溶液,试计算该硫酸溶液中溶质的质量分数(请写出计算过程)
3.92%
.