摘要:水的纯化 经过净化后的水只是干净的水.可以饮用.但 纯水.将自来水加热沸腾.变成蒸汽.再冷却凝结成水.这样制得的水.叫 .它是一种纯净水.含有较多钙离子.镁离子的水是 .长期饮用这种水对健康有害.工业上常采用蒸馏法或化学方法进行处理. 疑难突破 如何对混合物进行分离和提纯? 剖析:分离是将混合物通过物理方法使其各种物质分开的过程.提纯是用物理或化学的方法.除去混合物中的杂质或将混合物转变成被提纯的物质.在提纯中要注意不能引入新的杂质.必须使被提纯的物质容易与杂质分离. 分离和提纯物质常用的方法: 过滤:不溶性固体和液体的分离. 蒸发:可溶性固体和液体的分离. 蒸馏:分离几种液体混合物. 问题探究 问题 纯水清澈透明.不含杂质.而硬水含较多可溶性钙和镁的化合物.现有两瓶无色液体.分别为纯水和硬水.如何区别?对硬水如何净化? 探究:(1)利用吸附.沉淀.过滤和蒸馏等方法可净化水.其中能降低水的硬度的是蒸馏. (2)区别纯水和硬水的方法有多种.小雯采用的方法是:分别取样于蒸发皿中.加热蒸干.有固体析出的是硬水.请你设计另一种方法:向盛有两种液体的烧杯中加入肥皂水.产生泡沫多的是纯水.泡沫少的是硬水. (3)小雯在做实验时.发现硬水在蒸发过程中.产生了少量气体. [提出猜想]产生的气体可能是二氧化碳. [设计实验]将生成的气体通入澄清的石灰水中.观察到澄清的石灰水变浑浊的现象.证明产生的气体是二氧化碳. [反馈与应用]通过上述实验得到启发.在家里可用什么除去热水瓶胆内壁上的水垢. 区分纯水和硬水的方法有多种.除小雯的方法外.还可以用肥皂水来区分,小雯在实验过程中发现了新问题.结合所学知识分析可知小雯要探究的气体就是二氧化碳. 典题精讲 例1原水中含有泥沙.悬浮物和细菌等杂质.可用次氯酸杀死细菌.氯气溶于水时可生成盐酸和次氯酸.某水厂自来水的净化步骤如下:
网址:http://m.1010jiajiao.com/timu3_id_139646[举报]
某校化学兴趣小组的小伙伴们欲用生石灰制取氢氧化钠固体.他们将生石灰放入烧杯中,然后倒入碳酸钠溶液,充分反应后经过滤、洗涤、干燥得到固体A和溶液B.
(1)上述过程中发生的化学反应有(用化学方程式表示):①CaO+H2O=Ca(OH)2;
②______.
【查阅资料】NaOH、Ca(OH)2的溶解度
【猜想与假设Ⅰ】固体A的成分是什么呢?
小王的猜想:CaCO3;小雨的猜想:CaCO3和Ca(OH)2
(2)小雨同学认为固体A中可能含有Ca(OH)2的理由是______.
【实验与探究】小王和小雨为了验证各自的猜想,分别进行了实验:
【反思与评价】小伙伴们一致认为,上述实验可以证实______同学的猜想正确,从而确定了固体A的成分.
【猜想与假设Ⅱ】溶液B中的溶质是什么呢?
小马的猜想:NaOH和Na2CO3;小东的猜想:NaOH和Ca(OH)2;小龙的猜想:NaOH
【表达与交流】
①结合对固体A成分的探究实验,小伙伴们认为小东同学猜想正确.
②小伙伴们欲将溶液B加热浓缩,加热不久,溶液出现浑浊,只能停止加热,请解释加热时溶液出现浑浊的原因______.
③小伙伴们立即改变方案,先向B溶液中加入碳酸钠溶液后过滤,再将滤液加热浓缩至饱和,______、过滤、洗涤、烘干得纯净的氢氧化钠固体.
【拓展与延伸】
①久置的氢氧化钠固体易发生变质,其原因是(用化学方程式表示)______.
②实验室有一瓶氢氧化钠暴露在空气中,同学们对其成分进行了研究,称取样品6g,与足量稀盐酸反应后测得生成二氧化碳2.2g,计算该氢氧化钠中碳酸钠的质量分数.
③用上述数据不能测定部分变质的氢氧化钠样品中氢氧化钠的质量分数,理由是______.
查看习题详情和答案>>
(1)上述过程中发生的化学反应有(用化学方程式表示):①CaO+H2O=Ca(OH)2;
②______.
【查阅资料】NaOH、Ca(OH)2的溶解度
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| NaOH溶解度(g) | 42 | 109 | 129 | 174 | 314 | 347 |
| Ca(OH)2溶解度(g) | 0.18 | 0.16 | 0.14 | 0.12 | 0.09 | 0.07 |
小王的猜想:CaCO3;小雨的猜想:CaCO3和Ca(OH)2
(2)小雨同学认为固体A中可能含有Ca(OH)2的理由是______.
【实验与探究】小王和小雨为了验证各自的猜想,分别进行了实验:
| 实验内容 | 实验现象 | |
| 小王 | 取少量固体于试管中,再加入稀盐酸 | ______ |
| 小雨 | 取少量固体于试管中,加水充分振荡,过滤,向滤液中滴加______ | 溶液由无色变为红色 |
【猜想与假设Ⅱ】溶液B中的溶质是什么呢?
小马的猜想:NaOH和Na2CO3;小东的猜想:NaOH和Ca(OH)2;小龙的猜想:NaOH
【表达与交流】
①结合对固体A成分的探究实验,小伙伴们认为小东同学猜想正确.
②小伙伴们欲将溶液B加热浓缩,加热不久,溶液出现浑浊,只能停止加热,请解释加热时溶液出现浑浊的原因______.
③小伙伴们立即改变方案,先向B溶液中加入碳酸钠溶液后过滤,再将滤液加热浓缩至饱和,______、过滤、洗涤、烘干得纯净的氢氧化钠固体.
【拓展与延伸】
①久置的氢氧化钠固体易发生变质,其原因是(用化学方程式表示)______.
②实验室有一瓶氢氧化钠暴露在空气中,同学们对其成分进行了研究,称取样品6g,与足量稀盐酸反应后测得生成二氧化碳2.2g,计算该氢氧化钠中碳酸钠的质量分数.
③用上述数据不能测定部分变质的氢氧化钠样品中氢氧化钠的质量分数,理由是______.
粗盐中含有较多的可溶性杂质(氯化镁、氯化钙等)和不溶性杂质,回忆我们曾经做过的粗盐提纯的实验.
(1)粗盐提纯有如下步骤:
①计算产率 ②过滤 ③溶解 ④蒸发
正确的操作顺序是________(填编号),操作过程中使用次数最多的仪器是________.
A、漏斗 B、蒸发皿 C、玻璃棒 D、酒精灯
(2)最后得到的精盐属于________(填“混合物”或“纯净物”)
(3)实验结束后,有4个小组分别展示了计算的精盐产率:
| 组别 | 1 | 2 | 3 | 4 |
| 粗盐产率 | 75% | 65% | 88% | 72% |
A、1组:烧杯里的食盐为溶解完就开始过滤
B、2组:没有蒸发干,精盐中仍然有水分
C、3组:滤液浑浊就开始蒸发
D、4组:称量精盐时只有左盘垫了纸. 查看习题详情和答案>>
粗盐中含有较多的可溶性杂质(氯化镁、氯化钙等)和不溶性杂质,回忆我们曾经做过的粗盐提纯的实脸。
(1)粗盐提纯有如下步骤: ①计算产率 ②过滤 ③溶解解 ④蒸发 正确的操作顺序是 (填编号),操作过程中使用次数最多的仪器是 (填字母)。 A.漏斗 B.蒸发皿 C.玻璃棒 D.酒精灯
(2)最后得到的精盐属于 (填“混合物”或“纯净物”)。
(3)实验结束后,有4个小组分别展示了计算的精盐产率:
(1)粗盐提纯有如下步骤: ①计算产率 ②过滤 ③溶解解 ④蒸发 正确的操作顺序是 (填编号),操作过程中使用次数最多的仪器是 (填字母)。 A.漏斗 B.蒸发皿 C.玻璃棒 D.酒精灯
(2)最后得到的精盐属于 (填“混合物”或“纯净物”)。
(3)实验结束后,有4个小组分别展示了计算的精盐产率:

老师对各组的评价是:第3组结果偏高,其他组结果都偏低,于是各组分别讨论本组 的误差,所找原因正确的是 。
A.1组:烧杯里的食盐未溶解完就开始过滤
B.2组:没有蒸发干,精盐中仍然有水分
C.3组:滤液浑浊就开始蒸发
D.4组:称量精盐时只有左盘垫了纸
查看习题详情和答案>>
A.1组:烧杯里的食盐未溶解完就开始过滤
B.2组:没有蒸发干,精盐中仍然有水分
C.3组:滤液浑浊就开始蒸发
D.4组:称量精盐时只有左盘垫了纸
请你参与实验室用生石灰制取氢氧化钠固体的研究。将一定量的生石灰加入一只洁净的
烧杯中,加入碳酸钠溶液,充分反应后冷却到室温,通过过滤、洗涤、干燥得到固体A和
溶液B,请回答以下问题。
【查阅资料】NaOH 、Ca(OH)2的溶解度
(1)固体A中的成分是什么?
【猜想与假设】
甲同学认为是:CaCO3 乙同学认为是:CaCO3,Ca(OH)2
乙同学猜想可能含有Ca(OH)2的理由是 (用化学方程式表示)。
【实验与探究】为了验证各自的猜想,甲、乙同学分别进行了实验:
【反思与评价】同学讨论后认为,甲同学的实验 (填“能”或“不能”)证明固体A的成分,理由是 ;
结合甲、乙两位同学的实验证明了乙同学的猜想是正确的,因此确定了固体A的成分。
(2)溶液B中溶质的成分是什么?
【猜想与假设】丙同学认为是:NaOH、Na2CO3
丁同学认为是:NaOH、Ca(OH)2
戊同学认为是:NaOH
【表达与交流】
①结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,理由是 ;
②同学们欲将溶液B加热浓缩,加热不久,溶液出现浑浊,只好停止加热,请解释加热时溶液出现浑浊的原因是 ;
③同学们立即变换方案,向B溶液中加入适量的 ,过滤,将滤液加热浓缩至饱和, 、过滤、洗涤、烘干得到比较纯净的氢氧化钠固体。
④取少量制取的氢氧化钠固体溶解,进行焰色反应,观察到火焰呈 色。
烧杯中,加入碳酸钠溶液,充分反应后冷却到室温,通过过滤、洗涤、干燥得到固体A和
溶液B,请回答以下问题。
【查阅资料】NaOH 、Ca(OH)2的溶解度
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| NaOH的溶解度(g/100g水) | 42 | 109 | 129 | 174 | 314 | 347 |
| Ca(OH)2的溶解度(g/100g水) | 0.18 | 0.16 | 0.14 | 0. 12 | 0.09 | 0.07 |
(1)固体A中的成分是什么?
【猜想与假设】
甲同学认为是:CaCO3 乙同学认为是:CaCO3,Ca(OH)2
乙同学猜想可能含有Ca(OH)2的理由是 (用化学方程式表示)。
【实验与探究】为了验证各自的猜想,甲、乙同学分别进行了实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 甲同学:用一支洁净的试管取少量固体A,再加入过量稀盐酸。 | 有气泡产生 | 自己的猜想 正确 |
| 乙同学:用一支洁净的试管取少量固体A,加水,充分振荡,向上层清液中滴加 。 | 上层清液由无色变为红色 | 自己的猜想 正确 |
【反思与评价】同学讨论后认为,甲同学的实验 (填“能”或“不能”)证明固体A的成分,理由是 ;
结合甲、乙两位同学的实验证明了乙同学的猜想是正确的,因此确定了固体A的成分。
(2)溶液B中溶质的成分是什么?
【猜想与假设】丙同学认为是:NaOH、Na2CO3
丁同学认为是:NaOH、Ca(OH)2
戊同学认为是:NaOH
【表达与交流】
①结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,理由是 ;
②同学们欲将溶液B加热浓缩,加热不久,溶液出现浑浊,只好停止加热,请解释加热时溶液出现浑浊的原因是 ;
③同学们立即变换方案,向B溶液中加入适量的 ,过滤,将滤液加热浓缩至饱和, 、过滤、洗涤、烘干得到比较纯净的氢氧化钠固体。
④取少量制取的氢氧化钠固体溶解,进行焰色反应,观察到火焰呈 色。
某兴趣小组同学对实验室制备氧气的若干问题进行如下实验探究.
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ.将2.45g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将 x g KClO3与1.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.通常采用的方法有:
①测相同时间内产生O2的体积
②测
Ⅰ中反应的文字表达式是
Ⅱ中x的值应为
(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
【数据处理及结论】
I.本实验中,测量O2体积的装置是
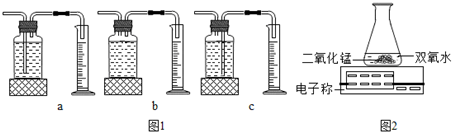
II.实验结论:在相同条件下,
III.丙用如图2装置进行实验,通过比较
(3)丙同学用KClO3和MnO2的混合物制取O2,完全反应后的固体残渣,经以下四步实验操作,回收得到了较纯净的MnO2(残渣中只有MnO2难于水).
他的正确操作先后顺序是
a.烘干 b.溶解 c.过滤 d.洗涤
步骤 c需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、
(4)丁同学在学习了质量守恒定律后,尝试计算了甲同学的实验中2.45g KClO3完全分解后生成O2的质量为
查看习题详情和答案>>
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ.将2.45g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将 x g KClO3与1.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.通常采用的方法有:
①测相同时间内产生O2的体积
②测
收集相同体积O2所需的时间
收集相同体积O2所需的时间
;Ⅰ中反应的文字表达式是
氯酸钾
氯化钾+氧气
| 二氧化锰 |
| 加热 |
氯酸钾
氯化钾+氧气
;| 二氧化锰 |
| 加热 |
Ⅱ中x的值应为
2.45
2.45
.(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
| I | 50.0g | 1% | 0.1g | 9mL |
| II | 50.0g | 2% | 0.1g | 16mL |
| III | 50.0g | 4% | 0.1g | 31mL |
I.本实验中,测量O2体积的装置是
c
c
(选填图1中“a”“b”“c”编号).
II.实验结论:在相同条件下,
双氧水浓度越大
双氧水浓度越大
,双氧水分解速率越快.III.丙用如图2装置进行实验,通过比较
相同时间天平读数差值大小(或电子称上示数减小的速度)
相同时间天平读数差值大小(或电子称上示数减小的速度)
也能达到实验目的.(3)丙同学用KClO3和MnO2的混合物制取O2,完全反应后的固体残渣,经以下四步实验操作,回收得到了较纯净的MnO2(残渣中只有MnO2难于水).
他的正确操作先后顺序是
bcda
bcda
(填写选项符号).a.烘干 b.溶解 c.过滤 d.洗涤
步骤 c需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、
玻璃棒
玻璃棒
,所填仪器在过滤操作中的作用是引流
引流
.(4)丁同学在学习了质量守恒定律后,尝试计算了甲同学的实验中2.45g KClO3完全分解后生成O2的质量为
0.96
0.96
g,标准状况下的O2体积为671.8
671.8
mL.(已知标准状况下,氧气密度为1.429g/L,结果精确到0.1mL)(无需写计算过程)