网址:http://m.1010jiajiao.com/timu3_id_139172[举报]
28.(15分)氮化铝(AlN)是一种新型无机材料,广泛应用与集成电路生产领域。某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
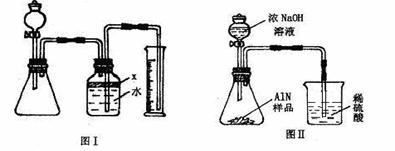
⑴实验有关操作为:a、往锥形瓶中放入适量的AlN样品:b、从分液漏斗往锥形瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积。正确的操作顺序为 。
⑵本试验中检查装置气密性的方法是 。
⑶广口瓶中的试剂X可选用 (填选项的标号)。A 汽油 B 酒精 C 植物油 D CCl4
⑷广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将_______(填偏大、偏小或不变)。
⑸实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是 。
⑹若实验中测得样品的质量为wg,氨气的体积为aL(标况下),则样品中AlN的质量分数为 (AlN的相对分子质量为41,每22.4L氨气质量为17g)。
⑺有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为是否可行? (填入“可行”、“不可行”)。原因是 ,改进的方法为 。
⑻在mg 20%的氢氧化钠溶液中滴加2~3滴酚酞试液,然后边搅拌边逐滴向其中加入硫酸镁溶液,至溶液的红色完全褪去时,滤去沉淀,称得剩余溶液总质量为3mg 。
①计算所加硫酸镁溶液的质量分数;(3分)
②用N表示溶液中离子的数目,不同种离子用离子符号注明[如N (Na')表示钠离子的数目],请建立坐标系,绘制上述滴加过程中各种离子的数目随溶液的不断加入而变化的关系图。(3分)
查看习题详情和答案>>实验目的:
测定生铁中铁的质量分数.
资料支撑:
生铁中除铁外,还含有碳、硅、锰、磷和硫等元素.碳在生铁中以两种形态存在:一种是单质碳(石墨),另一种是化合碳(如Fe3C等);硅、锰、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应.
设计思路:
要测定生铁中铁的质量分数,必须先通过实验测定并计算铁的质量,基本思路是
实验过程:
①取一只烧杯,称得其质量为70.4g,加入一定量生铁的样品碎屑,称得烧杯和样品的总质量为102.4g;
②向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入少量稀硫酸以确保过量,测得共用去稀硫酸247.3g;
③静置,称量.称得烧杯和剩余物质的总质量为348.7g.
数据处理:计算该生铁样品中单质铁的质量分数是多少?(写出计算过程)
交流讨论:
(1)实验过程中稀硫酸要过量的原因是:
(2)经质检部门精确测定,该样品中铁元素的总含量为95.2%.假设没有与稀硫酸反应的铁都以Fe3C形式存在,则样品中Fe3C的质量为
(3)该小组的同学还查阅到:一氧化碳具有可燃性,点燃一氧化碳与空气的混合物有可能爆炸.他们按下表中的体积比收集四瓶一氧化碳和空气的混合气,并点火实验,结果列于下表中:
| V(CO):V(空气) | 3:7 | 5:5 | 7:3 | 8:2 |
| 点火处理 | 炸 | 炸 | 炸 | 不炸 |
②由此我们得到启示:在点燃或加热一氧化碳前,一定要先
③一氧化碳还可用于炼铁,请写出一氧化碳与氧化铁反应的化学方程式:
某化学兴趣小组想对某次高炉炼铁得到的生铁中铁的质量分数进行探究,请按要求完成下列探究报告.
实验目的:
测定生铁中铁的质量分数.
资料支撑:
生铁中除铁外,还含有碳、硅、锰、磷和硫等元素.碳在生铁中以两种形态存在:一种是单质碳(石墨),另一种是化合碳(如Fe3C等);硅、锰、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应.
设计思路:
要测定生铁中铁的质量分数,必须先通过实验测定并计算铁的质量,基本思路是______.
实验过程:
①取一只烧杯,称得其质量为70.4g,加入一定量生铁的样品碎屑,称得烧杯和样品的总质量为102.4g;
②向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入少量稀硫酸以确保过量,测得共用去稀硫酸247.3g;
③静置,称量.称得烧杯和剩余物质的总质量为348.7g.
数据处理:计算该生铁样品中单质铁的质量分数是多少?(写出计算过程)
交流讨论:
(1)实验过程中稀硫酸要过量的原因是:______;
(2)经质检部门精确测定,该样品中铁元素的总含量为95.2%.假设没有与稀硫酸反应的铁都以Fe3C形式存在,则样品中Fe3C的质量为______(计算结果保留一位小数);
(3)该小组的同学还查阅到:一氧化碳具有可燃性,点燃一氧化碳与空气的混合物有可能爆炸.他们按下表中的体积比收集四瓶一氧化碳和空气的混合气,并点火实验,结果列于下表中:
| V(CO):V(空气) | 3:7 | 5:5 | 7:3 | 8:2 |
| 点火处理 | 炸 | 炸 | 炸 | 不炸 |
②由此我们得到启示:在点燃或加热一氧化碳前,一定要先______;
③一氧化碳还可用于炼铁,请写出一氧化碳与氧化铁反应的化学方程式:______. 查看习题详情和答案>>
实验目的:
测定生铁中铁的质量分数.
资料支撑:
生铁中除铁外,还含有碳、硅、锰、磷和硫等元素.碳在生铁中以两种形态存在:一种是单质碳(石墨),另一种是化合碳(如Fe3C等);硅、锰、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应.
设计思路:
要测定生铁中铁的质量分数,必须先通过实验测定并计算铁的质量,基本思路是______.
实验过程:
①取一只烧杯,称得其质量为70.4g,加入一定量生铁的样品碎屑,称得烧杯和样品的总质量为102.4g;
②向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入少量稀硫酸以确保过量,测得共用去稀硫酸247.3g;
③静置,称量.称得烧杯和剩余物质的总质量为348.7g.
数据处理:计算该生铁样品中单质铁的质量分数是多少?(写出计算过程)
交流讨论:
(1)实验过程中稀硫酸要过量的原因是:______;
(2)经质检部门精确测定,该样品中铁元素的总含量为95.2%.假设没有与稀硫酸反应的铁都以Fe3C形式存在,则样品中Fe3C的质量为______(计算结果保留一位小数);
(3)该小组的同学还查阅到:一氧化碳具有可燃性,点燃一氧化碳与空气的混合物有可能爆炸.他们按下表中的体积比收集四瓶一氧化碳和空气的混合气,并点火实验,结果列于下表中:
| V(CO):V(空气) | 3:7 | 5:5 | 7:3 | 8:2 |
| 点火处理 | 炸 | 炸 | 炸 | 不炸 |
②由此我们得到启示:在点燃或加热一氧化碳前,一定要先______;
③一氧化碳还可用于炼铁,请写出一氧化碳与氧化铁反应的化学方程式:______.
实验目的:
测定生铁中铁的质量分数.
资料支撑:
生铁中除铁外,还含有碳、硅、锰、磷和硫等元素.碳在生铁中以两种形态存在:一种是单质碳(石墨),另一种是化合碳(如Fe3C等);硅、锰、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应.
设计思路:
要测定生铁中铁的质量分数,必须先通过实验测定并计算铁的质量,基本思路是______.
实验过程:
①取一只烧杯,称得其质量为70.4g,加入一定量生铁的样品碎屑,称得烧杯和样品的总质量为102.4g;
②向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入少量稀硫酸以确保过量,测得共用去稀硫酸247.3g;
③静置,称量.称得烧杯和剩余物质的总质量为348.7g.
数据处理:计算该生铁样品中单质铁的质量分数是多少?(写出计算过程)
交流讨论:
(1)实验过程中稀硫酸要过量的原因是:______;
(2)经质检部门精确测定,该样品中铁元素的总含量为95.2%.假设没有与稀硫酸反应的铁都以Fe3C形式存在,则样品中Fe3C的质量为______(计算结果保留一位小数);
(3)该小组的同学还查阅到:一氧化碳具有可燃性,点燃一氧化碳与空气的混合物有可能爆炸.他们按下表中的体积比收集四瓶一氧化碳和空气的混合气,并点火实验,结果列于下表中:
| V(CO):V(空气) | 3:7 | 5:5 | 7:3 | 8:2 |
| 点火处理 | 炸 | 炸 | 炸 | 不炸 |
②由此我们得到启示:在点燃或加热一氧化碳前,一定要先______;
③一氧化碳还可用于炼铁,请写出一氧化碳与氧化铁反应的化学方程式:______ 2Fe+3CO2 查看习题详情和答案>>