摘要:16.NaNO .NaCl和物质M的溶解度曲线如图1所示.请根据图像和有关信息回答下列问题: (1)t℃时.NaNO.NaCl和M的溶解度由大到小的顺序是 . (2)分别将NaNO.NaCl和M的饱和溶液从t℃降温到t℃.三种溶液中溶质的质量分 数由大到小的顺序是 . (3)如图2所示.当往试管中加入5mL稀盐酸时.试管内立即产生大量气泡.同时放热使烧杯中的饱和溶液变浑浊.请判断:该饱和溶液中的溶质是 (填“NANO"或“NaCl 或“M ).
网址:http://m.1010jiajiao.com/timu3_id_133497[举报]
海洋是个巨大的宝库,为人类提供了宝贵的自然资源.
(1)食用海鱼摄取的主要营养素是
(2)如图1为海水淡化装置,利用的能源是
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量
(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为
资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
(5)从海水中提取溴常用吹出法,即用氯气将海水里的溴化钠中的溴置换出来,再用空气或水蒸气吹出溴.流程示意图如图2:
①写出氯气置换出溴单质的化学方程式;
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是

查看习题详情和答案>>
(1)食用海鱼摄取的主要营养素是
蛋白质
蛋白质
.(2)如图1为海水淡化装置,利用的能源是
太阳能
太阳能
,获得的蒸馏水属于B
B
.A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品.用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质.除去上述杂质,先加过量的BaCl2溶液除去,再加过量
Na2CO3
Na2CO3
溶液除去CaCl2和过量的BaCl2,生成的沉淀经CaCO3、BaCO3
CaCO3、BaCO3
除去,最后加入稀盐酸
稀盐酸
调节pH,蒸发、结晶,制得粗盐.(4)用氯化钠和碳酸氢铵可制备碳酸氢钠和氯化铵,该反应化学方程式可表示为;NaCl+NH4HCO3=NaHCO3+NH4Cl.20℃时,按上述化学方程式中反应物的质量比,向100克水中加入11.7克NaCl和15.8克NH4HCO3,理论上从溶液中提出晶体的质量为
7.2
7.2
g.资料:20℃时四种物质的溶解度如下:假设它们同时溶解在水中各自的溶解度不变,
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
①写出氯气置换出溴单质的化学方程式;
Cl2+2NaBr=2NaCl+Br2
Cl2+2NaBr=2NaCl+Br2
;该反应在pH=3的酸性条件下进行,可用pH试纸
pH试纸
测定反应液的酸碱度.②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应;Br2+SO2+2H2O?H2SO4+2HBr).根据流程图分析,通入SO2的目的是
分离溴与空气
分离溴与空气
.
 (2012?北京)海洋为人类提供了宝贵的自然资源.
(2012?北京)海洋为人类提供了宝贵的自然资源.(1)食用海鱼摄取的主要营养素是
蛋白质
蛋白质
.(2)右图为海水淡化装置,利用的能源是
太阳能
太阳能
,获得的蒸馏水属于B
B
(填字母序号).A.单质 B.化合物 C.混合物
(3)从海水中提取食盐,采用的方法是
蒸发结晶
蒸发结晶
.(4)用氯化钠和碳酸氢铵(NH4HCO3)可制备碳酸氢钠和氯化铵(NH4Cl),该反应可表示为:NaCl+NH4HCO3═NaHCO3+NH4Cl.
20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7g NaCl和15.8g NH4HCO3.理论上从溶液中析出晶体的质量为
7.2
7.2
g.资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变.
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| 溶解度/g | 36.0 | 21.6 | 37.2 | 9.6 |
 19、物质发生化学变化的前后,总质量是否发生改变?是增加、减小还是不变?小刘、小李按下面的步骤进行探究:
19、物质发生化学变化的前后,总质量是否发生改变?是增加、减小还是不变?小刘、小李按下面的步骤进行探究:(1)提出假设:物质发生化学变化前后总质量不变.
(2)设计并进行实验:小刘设计的实验装置和选用药品
如A所示,小李设计的实验装置和选用药品如B所示,
他们在反应前后都进行了规范的操作、准确的称量和
细致的观察.
①这两个实验所发生的化学反应方程式为:小刘的实验:
BaCl2+Na2S04=BaS04↓+2NaCl,
小李的实验:Na2C03+2HCl=2NaCl+H20+C02↑
②实验结论:
小刘认为:在化学反应中,生成物的总质量与反应物的总质量相等;
小李认为:在化学反应中,生成物总质量与反应物总质量不相等.
③你认为
小刘
的结论正确,导致另一个实验结论错误的原因是:小李的实验漏掉生成物的气体的质量.
,应如何改进将反应物放在密闭容器中进行
.④请从原子的角度分析你认为正确的结论的原因:
在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变
⑤使用上述实验装置,请你选择另外两种药品进行实验达到实验目的,这两种药品可以是
NaCl
和
AgNO3
(填化学式)[注:以上四种药品均不能再用].先阅读下列短文,再回答下列问题:
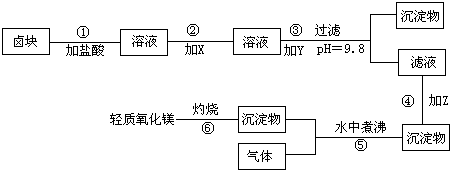
在酸性条件下,次氯酸钠(NaClO)、过氧化氢都有很强的氧化性,可将Fe2+氧化为Fe3+.Mg(OH)2和Fe(0H)3在溶液中生成时呈胶状物或絮状物沉淀,而MgCO3在水中煮沸可转变为Mg(OH)2.“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按如图工艺流程即可制得“轻质氧化镁”.若要求产品不含杂质离子,而且成本较低,流程中所用试剂或pH控制可参考表1、表2来确定.
表1:
表2:
请填下列空白:
(1)写出盐酸溶液中NaClO将FeCl2氧化成FeCl3,同时生成NaCl和H2O的化学方程式:
(2)在步骤2中加入物质X,最佳的选择应是
(3)在步骤3中加入的物质应是
(4)在步骤4中加入物质应是
(5)在步骤5中发生的化学方程式为
查看习题详情和答案>>

在酸性条件下,次氯酸钠(NaClO)、过氧化氢都有很强的氧化性,可将Fe2+氧化为Fe3+.Mg(OH)2和Fe(0H)3在溶液中生成时呈胶状物或絮状物沉淀,而MgCO3在水中煮沸可转变为Mg(OH)2.“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按如图工艺流程即可制得“轻质氧化镁”.若要求产品不含杂质离子,而且成本较低,流程中所用试剂或pH控制可参考表1、表2来确定.
表1:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)3 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 工业品 | 规格 | 价格(元/吨) |
| 漂液 | 含NaClO 25.5% | 450 |
| 过氧化氢 | 含H2O230% | 240 |
| 烧碱 | 含NaOH 98% | 2100 |
| 纯碱 | 含Na2CO3 99.5% | 600 |
| 卤块 | 含MgCl2 30% | 310 |
(1)写出盐酸溶液中NaClO将FeCl2氧化成FeCl3,同时生成NaCl和H2O的化学方程式:
NaClO+2FeCl2+2HCl═2FeCl3+NaCl+H2O
NaClO+2FeCl2+2HCl═2FeCl3+NaCl+H2O
,写出在盐酸溶液中H2O2将FeCl2氧化成FeCl3,同时生成H2O的化学方程式:H2O2+2HCl+2FeCl2═2FeCl3+2H2O
H2O2+2HCl+2FeCl2═2FeCl3+2H2O
.(2)在步骤2中加入物质X,最佳的选择应是
过氧化氢
过氧化氢
,理由是使用H2O2溶液成本低,且不含其他杂质离子
使用H2O2溶液成本低,且不含其他杂质离子
.(3)在步骤3中加入的物质应是
NaOH溶液
NaOH溶液
,之所以要控制pH=9.8,其目的是使FeCl3、MnCl2都转化为Fe(OH)3、Mn(OH)2沉淀,而大部分MgCl2尚未转化为Mg(OH)2,仍以MgCl2留在滤液中,达到分离杂质的目的
使FeCl3、MnCl2都转化为Fe(OH)3、Mn(OH)2沉淀,而大部分MgCl2尚未转化为Mg(OH)2,仍以MgCl2留在滤液中,达到分离杂质的目的
.(4)在步骤4中加入物质应是
碳酸钠
碳酸钠
.(5)在步骤5中发生的化学方程式为
MgCO3+H2O
Mg(OH)2+CO2↑
| ||
MgCO3+H2O
Mg(OH)2+CO2↑
.
| ||
 (2013?奉贤区二模)我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样配成溶液,向其中逐滴加入CaCl2溶液,产生沉淀物质的量与所加CaCl2的物质量关系如图所示.
(2013?奉贤区二模)我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样配成溶液,向其中逐滴加入CaCl2溶液,产生沉淀物质的量与所加CaCl2的物质量关系如图所示.