摘要:10%的NaOH溶液10g与10%的盐酸10g混合后.再向反应后的溶液中滴加紫色石蕊试液.则溶液是( ) A.紫色 B.蓝色 C.红色 D.无色
网址:http://m.1010jiajiao.com/timu3_id_131128[举报]
小忻和小燕合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计并进行了如下两个探究实验:
【实验1】取20g该混合酸并分成4等份,然后分别加入一定量未知质量分数的BaCl2溶液,实验记录如下:
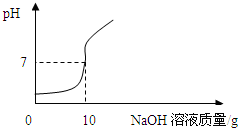
【实验2】将【实验1】中的第4份反应液过滤,再向滤液中逐滴加入10%的NaOH溶液,通过pH测定仪打印出加入NaOH溶液的质量与烧杯中溶液pH的关系如图:
【数据处理】
小忻依据【实验1】沉淀的质量计算出混合酸
中H2SO4的质量分数.
小燕依据【实验2】求混合酸中HCl的质量分数,过程如下:
解:设混合酸中HCl的质量分数为ω.
HCl+NaOH=NaCl+H2O
36.5 40
×ω 10g×10%
解得:ω=0,1825=18.25%
现请你参与探究并完成相关问题.(可能用到的相对分子质量:H2SO4-98BaSO4-233 BaCl2-208 )
(1)【实验1】中发生反应的化学方程式为 .
(2)小忻测出原混合酸中H2SO4的质量分数为 (保留三位有效数字).
(3)小燕计算出混合酸中HCl的质量分数会 (填“偏高”、“偏低”或“无影响”),理由是
(如“无影响”,本空不作答). 查看习题详情和答案>>
【实验1】取20g该混合酸并分成4等份,然后分别加入一定量未知质量分数的BaCl2溶液,实验记录如下:
| 第1份 | 第2份 | 第3份 | 第4份 | |
| 加入BaCl2 溶液的质量/g |
15 | 20 | 25 | 30 |
| 反应得到的沉淀的质量/g | 1.398 | 1.864 | 2.330 | 2.330 |

【数据处理】
小忻依据【实验1】沉淀的质量计算出混合酸
中H2SO4的质量分数.
小燕依据【实验2】求混合酸中HCl的质量分数,过程如下:
解:设混合酸中HCl的质量分数为ω.
HCl+NaOH=NaCl+H2O
36.5 40
| 20g |
| 4 |
解得:ω=0,1825=18.25%
现请你参与探究并完成相关问题.(可能用到的相对分子质量:H2SO4-98BaSO4-233 BaCl2-208 )
(1)【实验1】中发生反应的化学方程式为
(2)小忻测出原混合酸中H2SO4的质量分数为
(3)小燕计算出混合酸中HCl的质量分数会
(如“无影响”,本空不作答). 查看习题详情和答案>>
 小璐和小磊合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计进行了如下两个探究实验:
小璐和小磊合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计进行了如下两个探究实验:[实验1]取20g该混合酸并分成4等份,分别加入一定量未知质量分数的BaCl2溶液,记录如下:
| 第1份 | 第2份 | 第3份 | 第4份 | |
| 加入BaCl2溶液的质量/g | 15 | 20 | 25 | 30 |
| 反应得到的沉淀的质量/g | 1.398 | 1.864 | 2.330 | 2.330 |
[数据处理]
小璐依据[实验1]沉淀的质量计算出混合酸中H2SO4的质量分数.
小磊依据[实验2]求混合酸中HCl的质量分数,过程如下:
解:设混合酸中HCl的质量分数为ω.
HCl+NaOH=NaCl+H2O
36.5 40
| 20g |
| 4 |
解得:ω=0.1825=18.25%
现请你参与探究并完成相关问题.
(1)[实验1]中发生反应的化学方程式为
BaCl2+H2SO4=2HCl+BaSO4↓.
BaCl2+H2SO4=2HCl+BaSO4↓.
.(2)根据小璐的计算,测出原混合酸中H2SO4的质量分数为多少?(保留三位有效数字).
[反思交流]小磊计算出混合酸中HCl的质量分数会
偏高
偏高
(填“偏高”、“偏低”或“无影响”),理由是因为BaCl2与H2SO4反应后有盐酸生成,从而使滤液中的盐酸的质量增大.
因为BaCl2与H2SO4反应后有盐酸生成,从而使滤液中的盐酸的质量增大.
(如“无影响”,本空不作答).
小忻和小燕合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计并进行了如下两个探究实验:
【实验1】取20g该混合酸并分成4等份,然后分别加入一定量未知质量分数的BaCl2溶液,实验记录如下:
| 第1份 | 第2份 | 第3份 | 第4份 | |
| 加入BaCl2 溶液的质量/g | 15 | 20 | 25 | 30 |
| 反应得到的沉淀的质量/g | 1.398 | 1.864 | 2.330 | 2.330 |

【数据处理】
小忻依据【实验1】沉淀的质量计算出混合酸
中H2SO4的质量分数.
小燕依据【实验2】求混合酸中HCl的质量分数,过程如下:
解:设混合酸中HCl的质量分数为ω.
HCl+NaOH=NaCl+H2O
36.5 40
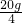 ×ω 10g×10%
×ω 10g×10%解得:ω=0,1825=18.25%
现请你参与探究并完成相关问题.(可能用到的相对分子质量:H2SO4-98BaSO4-233 BaCl2-208 )
(1)【实验1】中发生反应的化学方程式为______.
(2)小忻测出原混合酸中H2SO4的质量分数为______(保留三位有效数字).
(3)小燕计算出混合酸中HCl的质量分数会______(填“偏高”、“偏低”或“无影响”),理由是______
(如“无影响”,本空不作答). 查看习题详情和答案>>
28.(2007?佛山)小忻和小燕合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计并进行了如下两个探究实验:
【实验1】取20g该混合酸并分成4等份,然后分别加入一定量未知质量分数的BaCl2溶液,实验记录如下:
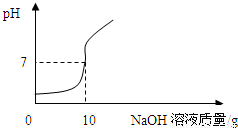
【实验2】将【实验1】中的第4份反应液过滤,再向滤液中逐滴加入10%的NaOH溶液,通过pH测定仪打印出加入NaOH溶液的质量与烧杯中溶液pH的关系如图:
【数据处理】
小忻依据【实验1】沉淀的质量计算出混合酸
中H2SO4的质量分数.
小燕依据【实验2】求混合酸中HCl的质量分数,过程如下:
解:设混合酸中HCl的质量分数为ω.
HCl+NaOH=NaCl+H2O
36.5 40
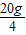 ×ω 10g×10%
×ω 10g×10%
解得:ω=0,1825=18.25%
现请你参与探究并完成相关问题.(可能用到的相对分子质量:H2SO4-98BaSO4-233 BaCl2-208 )
(1)【实验1】中发生反应的化学方程式为______.
(2)小忻测出原混合酸中H2SO4的质量分数为______(保留三位有效数字).
(3)小燕计算出混合酸中HCl的质量分数会______(填“偏高”、“偏低”或“无影响”),理由是______
(如“无影响”,本空不作答).
查看习题详情和答案>>
【实验1】取20g该混合酸并分成4等份,然后分别加入一定量未知质量分数的BaCl2溶液,实验记录如下:
| 第1份 | 第2份 | 第3份 | 第4份 | |
| 加入BaCl2 溶液的质量/g | 15 | 20 | 25 | 30 |
| 反应得到的沉淀的质量/g | 1.398 | 1.864 | 2.330 | 2.330 |

【数据处理】
小忻依据【实验1】沉淀的质量计算出混合酸
中H2SO4的质量分数.
小燕依据【实验2】求混合酸中HCl的质量分数,过程如下:
解:设混合酸中HCl的质量分数为ω.
HCl+NaOH=NaCl+H2O
36.5 40
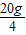 ×ω 10g×10%
×ω 10g×10%解得:ω=0,1825=18.25%
现请你参与探究并完成相关问题.(可能用到的相对分子质量:H2SO4-98BaSO4-233 BaCl2-208 )
(1)【实验1】中发生反应的化学方程式为______.
(2)小忻测出原混合酸中H2SO4的质量分数为______(保留三位有效数字).
(3)小燕计算出混合酸中HCl的质量分数会______(填“偏高”、“偏低”或“无影响”),理由是______
(如“无影响”,本空不作答).
查看习题详情和答案>>