网址:http://m.1010jiajiao.com/timu3_id_130825[举报]
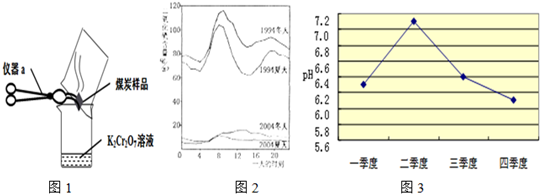
(1)如果硫粉在氧气中燃烧,观察到的现象是
| ||
| ||
(2)几位同学为了探究木炭中是否含有少量硫元素,他们设计了如图1所示实验进行测定.请写出图中仪器a的名称:
 +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:(3)如图2是1994年和2004年某城市的一天各个时刻测到的空气中二氧化硫的含量.下列说法不正确的是
A.曲线显示冬天大气中的二氧化硫含量比夏天高
B.曲线显示了1994年一天中大约8点左右二氧化硫的含量较高
C.二氧化硫的含量在10年间降低的原因可能是加强了燃料的脱硫和控制了二氧化硫的排放
D.二氧化硫污染的主要来源是汽车排放的尾气,控制污染的方法是禁止使用汽车
(4)在研究酸雨危害的过程中,测定该地区雨水的pH的实验操作
某化学兴趣小组取刚降到地面的雨水,每隔一定时间用较精密的pH计测定其pH,数据如下:
| 测定时间/分钟 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(5)酸雨造成的危害很多.某兴趣小组调查发现某市的石刻的表面有不同程度的腐蚀.且近20年的腐蚀速度大大超过以往,其中最主要原因之一就是酸雨.为了减缓石刻腐蚀,请你提一条建议:
酸雨还会使土壤酸化.为了中和酸性土壤,可以使用熟石灰粉末,若该酸雨的成分是硫酸,请写出该中和反应的化学方程式
(6)某校化学兴趣小组在学完碱的化学性质后,想到用NaOH溶液吸收SO2,反应化学方程式如下:2NaOH+SO2═Na2SO3+H2O 用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g.已知此时空气的密度约为1.3g/L,求:
①被吸收的SO2的质量
②发生反应的NaOH的质量.(相对原子质量:Na-23 S-32 O-16)
③空气中SO2的质量分数(计算结果精确到0.01%).
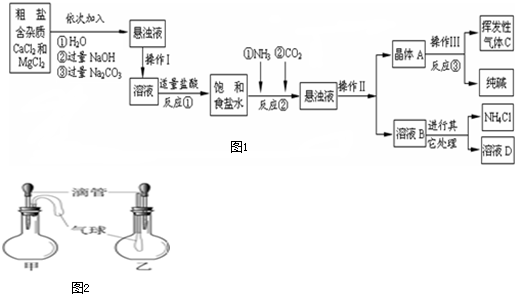
【产品与原理】该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为:
【生产流程】如图1
【相关资料】
(1)NH4Cl
| ||
(2)已知20℃时有关物质的溶解度如表(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
(2)反应①中发生了两个反应,写出这两个化学方程式:①
(3)反应③中得到纯碱的化学方程式为:
(4)溶液B中的溶质有
(5)上述生产流程中可循环使用的是
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
(6)检验挥发性气体C的方法
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀. 由上述实验可确定纯碱样品含有杂质
【综合确定】
(1)如图2所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.则滴管和烧瓶中所用试剂可能是:
A.甲:稀硫酸和铜片;乙:水和CO2 B.甲:水和NH4NO3;乙:双氧水和MnO2
C.甲:水和NH3;乙:硝酸银溶液和HCl D.甲:CaCO3固体和稀盐酸;乙:NaOH溶液和SO2
(2)小明同学把12gNaOH固体等分成A、B、C三份并采用不同方法保存.几天后,A未变质、B部分变质、C全部变质,他将三份固体分别配成溶液并滴入10%的稀硫酸直到正好反应.下列说法正确的是
A.几天后,三份固体的质量由小到大的顺序为:A<B<C
B.为控制正好反应,A可用酚酞试液指示,B、C可滴加稀硫酸直到正好不冒气泡
C.正好反应时,消耗稀硫酸的质量由大到小的顺序为:A>B>C
D.正好反应时,生成硫酸钠的质量都相等,均为7.1g
(3)工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:①4NH3+5O2=4NO+6H2O ②2NO+O2=2NO2 ③3NO2+H2O=2HNO3+NO,下列判断不正确的是
A.①反应中使用的催化剂需要经常更换 B.在每一步反应中N元素的化合价都发生了改变
C.制取硝酸过程中产生的NO可循环使用
D.为实现原子利用率为100%,可在②③中控制NO、O2和H2O分子个数比为4:3:2
(4)某学生为了验证铁、锌、铜三种金属的活动性顺序.设计了四种方案:①将Zn、Cu分别加入到FeSO4溶液中 ②将Fe、Cu分别加入到ZnSO4溶液中 ③将Zn分别加入到FeSO4、CuSO4溶液中 ④将Fe分别加入到ZnSO4、CuSO4溶液中.其中可行的是
A.①④B.①②C.②③D.③④
(1)目前,我国火力发电厂燃料主要是煤.煤燃烧会排放出SO2和NO2,这些气体不仅污染空气,而且与空气中的物质反应后,生成的物质溶于雨水,会形成“酸雨”.请按要求回答下列问题:
①二氧化硫与空气中水分反应生成亚硫酸(H2SO3),亚硫酸易与氧气反应生成硫酸.其中亚硫酸与氧气的化学方程式是______.
②NO2是一种红棕色气体.在盛有NO2的集气瓶中放入一块活性炭,过一会儿,瓶内红棕色变淡甚至消失,活性炭具有的这种性质叫做______.
③对于SO2和NO2,小余同学归纳出了如下一些共同点,其中正确的是______
A.都是非金属氧化物 B.硫元素和氮元素化合价都为+2价
C.每个分子都由3个原子构成 D.常温常压下都是有颜色的气体
(2)五.一节放假结束后,小王来到实验室,发现一瓶氢氧化钠固体敞放着,这引起了她的研究欲望.
【提出问题】氢氧化钠是否变质?若发生变质,其程度如何?
【查阅资料】碳酸钠水溶液显碱性,氯化钠、氯化钙水溶液显中性.
【进行试验】Ⅰ.取样品少许,加入稀盐酸有气泡产生;
Ⅱ.取样品少许,加水溶解后,滴入酚酞显红色;
Ⅲ.按如图所示过程,进一步实验:

请你与小王同学一道完成下列问题的分析解答:
①氢氧化钠变质的化学反应方程式是______.
②完成步骤a、b实验,都要使用的两件玻璃仪器是______.
③步骤b中,不能用Ca(OH)2代替CaCl2的原因是______
根据上述实验,若测定wg样品中氢氧化钠的质量分数,还须测定的数据是______.
A.测定沉淀A 的质量
B.溶液B蒸发溶剂,测定残留固体的质量
C.溶液B与稀硫酸中和,测定消耗H2SO4的质量.
查看习题详情和答案>>
(1) 目前,我国火力发电厂燃料主要是煤。煤燃烧会排放出SO2和NO2,这些气体不仅污染空气,而且与空气中的物质反应后,生成的物质溶于雨水,会形成“酸雨”。请按要求回答下列问题:
①二氧化硫与空气中水份反应生成亚硫酸(H2SO3),亚硫酸易与氧气反应生成硫酸。其中亚硫酸与氧气的化学方程式是 。
②NO2是一种红棕色气体。在盛有NO2的集气瓶中放入一块活性炭,过一会儿,瓶内红棕色变淡甚至消失,活性炭具有的这种性质叫做 。
③对于SO2和NO2,小余同学归纳出了如下一些共同点,其中正确的是
A. 都是非金属氧化物 B.硫元素和氮元素化合价都为+2价
C.每个分子都由3个原子构成 D.常温常压下都是有颜色的气体
(2)五.一节放假结束后,小王来到实验室,发现一瓶氢氧化钠固体敞放着,这引起了她的研究欲望。
【提出问题】氢氧化钠是否变质?若发生变质,其程度如何?
【查阅资料】碳酸钠水溶液显碱性,氯化钠、氯化钙水溶液显中性。
【进行试验】Ⅰ.取样品少许,加入稀盐酸有气泡产生;
Ⅱ. 取样品少许,加水溶解后,滴入酚酞显红色;
Ⅲ.按下图所示过程,进一步实验:

请你与小王同学一道完成下列问题的分析解答:
①氢氧化钠变质的化学反应方程式是 。
②完成步骤a、b实验,都要使用的两件玻璃仪器是 。
③步骤b中,不能用Ca(OH)2代替CaCl2的原因是——————————————————
④根据上述实验,若测定wg样品中氢氧化钠的质量分数,还须测定的数据是——
A.测定沉淀A 的质量
B.溶液B蒸发溶剂,测定残留固体的质量
C.溶液B与稀硫酸中和,测定消耗H2SO4的质量
查看习题详情和答案>>