摘要:普鲁卡因(化学式是C13H20O2N2)是一种常用止痛药剂.下列说法中.正确的是-----------------------------( ) A.普鲁卡因是由碳.氢.氧.氮四种元素组成的 B.普鲁卡因中含有氮气分子 C.普鲁卡因中碳.氢.氧.氮四种元素质量比为13∶20∶2∶2 D.普鲁卡因的相对分子质量为37
网址:http://m.1010jiajiao.com/timu3_id_129291[举报]
普鲁卡因(化学式是C13H20O2N2)是一种止痛药剂,下列说法中正确的是( )
| A、普鲁卡因是由碳、氢、氧、氮四种元素组成的 | B、普鲁卡因中含有氮气分子 | C、普鲁卡因中碳、氢、氧、氮四种元素质量比为13:20:2:2 | D、普鲁卡因的相对分子质量为37 |
普鲁卡因(化学式是C13H20O2N2)是一种止痛药剂,下列说法中正确的是( )
查看习题详情和答案>>
| A.普鲁卡因是由碳、氢、氧、氮四种元素组成的 |
| B.普鲁卡因中含有氮气分子 |
| C.普鲁卡因中碳、氢、氧、氮四种元素质量比为13:20:2:2 |
| D.普鲁卡因的相对分子质量为37 |
老的康泰克是一种常用的抗感冒药,因含PPA成份而被国家药品监督管理局于2000年要求各医药部门暂停使用和销售.PPA的化学式是C9H13NO.该物质由
查看习题详情和答案>>
四
四
种元素组成,每个PPA分子中含有24
24
个原子.其式量是151
151
.该成份中,C、H、N、O四种元素的质量比是108:13:14:16
108:13:14:16
,其质量分数最高的元素是碳元素
碳元素
.氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂.
【资料在线】
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙.
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝.
探究一:定性分析
(1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气你支持
(2)CaH2中氢元素的化合价是
(3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是
(4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图.
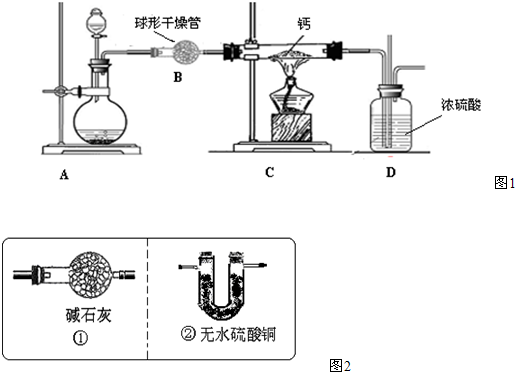
装置A 中装有锌粒和稀硫酸,请写出其反应的化学方程式
(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确
探究二:产物定量测定
测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法.
(1)取氢化钙样品与水反应,利用图1装置测定生成的气体体积时,在
A.气泡连续均匀时
B.刚开始有气泡时
(2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用图2装置测定气体体积.该装置的优点是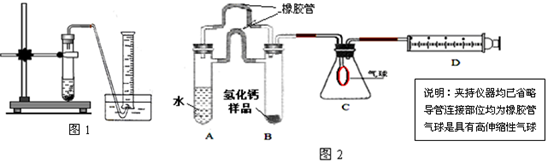
(3)称取46mg 所制得的氢化钙样品,注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是
反思提高:
(1)上述实验在学校的实验室内,通过托盘天平等称量工具
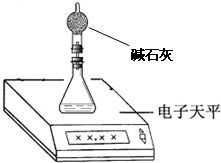
(2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏
查看习题详情和答案>>
【资料在线】
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙.
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝.
探究一:定性分析
(1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气你支持
乙
乙
(填“甲”、“乙”)观点,理由是钙与水反应若生成氧气,反应前后氢氧原子个数比不守恒(反应前氢氧原子个数比为2/1,反应后会大于2/1)
钙与水反应若生成氧气,反应前后氢氧原子个数比不守恒(反应前氢氧原子个数比为2/1,反应后会大于2/1)
.(2)CaH2中氢元素的化合价是
-1
-1
,写出CaH2与水反应的化学方程式CaH2+2H2O═Ca(OH)2+2H2↑
CaH2+2H2O═Ca(OH)2+2H2↑
;(3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是
固体燃料携带方便,且水是登山运动员必须携带物质,有水就能提供出高能量的氢能
固体燃料携带方便,且水是登山运动员必须携带物质,有水就能提供出高能量的氢能
;(4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图.

装置A 中装有锌粒和稀硫酸,请写出其反应的化学方程式
Zn+H2SO4═ZnSO4+H2↑;
Zn+H2SO4═ZnSO4+H2↑;
,装置B 中装有无水氯化钙,其作用是除去氢气中混有的水蒸气
除去氢气中混有的水蒸气
,若要证明进入C 装置中的氢气已经干燥,在B、C之间应连接下图中的哪个装置:②
②
(填①或②),现象是无水硫酸铜不变色
无水硫酸铜不变色
.(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确
否
否
(填“是”或“否”);原因是因为Ca+2H2O═Ca(OH)2+H2↑也能呈现相同的现象
因为Ca+2H2O═Ca(OH)2+H2↑也能呈现相同的现象
.探究二:产物定量测定
测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法.
(1)取氢化钙样品与水反应,利用图1装置测定生成的气体体积时,在
B
B
即进行收集(填字母).A.气泡连续均匀时
B.刚开始有气泡时
(2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用图2装置测定气体体积.该装置的优点是
①排除了“因液体加入引起气体排出导致的气体体积测定误差”的可能;②避免了实验操作时,无论塞紧橡皮塞的动作多快,都会有气体逸散的可能;③胶皮管能使两支管内中气体压强保持平衡,便于管A中液体顺利流入管B;④评价气球:气球膨胀过程还可以在一定程度上缓冲一下压强,以防氢气直接快速进入注射器,造成活塞脱落,导致实验失败
①排除了“因液体加入引起气体排出导致的气体体积测定误差”的可能;②避免了实验操作时,无论塞紧橡皮塞的动作多快,都会有气体逸散的可能;③胶皮管能使两支管内中气体压强保持平衡,便于管A中液体顺利流入管B;④评价气球:气球膨胀过程还可以在一定程度上缓冲一下压强,以防氢气直接快速进入注射器,造成活塞脱落,导致实验失败
,如何实现A中的水与B中样品接触而发生反应因为AB管连接处均有胶皮管连接,所以慢慢倾斜A管,直至液体流入B
因为AB管连接处均有胶皮管连接,所以慢慢倾斜A管,直至液体流入B
.
(3)称取46mg 所制得的氢化钙样品,注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是
91.30%
91.30%
.(设该条件下每11.2mL氢气的质量为1mg)反思提高:
(1)上述实验在学校的实验室内,通过托盘天平等称量工具
不能
不能
(填“能”、“不能”)完成.(2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏
偏低
偏低
.
 (2013?启东市模拟)(1)粉笔是一种常用的教学用品,已知其主要成分中含有钙元素.小强和小雯同学一起探究粉笔的组成.
(2013?启东市模拟)(1)粉笔是一种常用的教学用品,已知其主要成分中含有钙元素.小强和小雯同学一起探究粉笔的组成.[提出问题]白色粉笔的主要成分是什么?
[猜 想]小强认为:可能含有CaCO3; 小雯认为:可能含CaSO4
为证明他们的猜想是否正确,请你参与方案的设计并补充完整.
①将少量的粉笔灰放入水中,搅拌后形成悬浊液.取出过滤所得滤液和滤渣分别进行实验;
②取少量滤渣与
稀盐酸
稀盐酸
反应,如果观察到有气泡产生
有气泡产生
的现象,证明小强的猜想是正确的.③另取少量滤液,向其中滴入
Ba(NO3)2
Ba(NO3)2
溶液和稀硝酸,如果观察到白色沉淀
白色沉淀
的现象,则证明小雯的猜想是正确的.(2)实验室制取二氧化碳所用的实验装置如图所示.请回答有关问题:
用大理石和稀盐酸制取二氧化碳的化学方程式是
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
,收集方法是向上排空气法收集
向上排空气法收集
.制取二氧化碳后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质不溶于水且不参加反应):甲、乙同学分析认为剩余溶液中一定有氯化钙,可能有盐酸.为验证是否含有盐酸,他们采用了不同的方法进行实验,得到了相同的结论.查找资料:氯化钙溶液呈中性
| 实验操作 | 实验现象 | 结论 | |
| 甲 | 取样于试管中,滴加 石蕊 石蕊 试液 |
试液变红 | 有盐酸 |
| 乙 | 取样于试管中,逐滴滴加碳酸钠溶液至过量 | 有气泡生产 有气泡生产 |
因溶液中一定含有氯化钙,氯化钙和硝酸银反应也可以产生白色沉淀,不能证明稀盐酸的存在
因溶液中一定含有氯化钙,氯化钙和硝酸银反应也可以产生白色沉淀,不能证明稀盐酸的存在
.从剩余溶液中得到尽可能多的氯化钙固体.同学们认为加入稍过量的
Na2CO3
Na2CO3
(填化学式),经过滤
过滤
、蒸发等操作后即可完成.