摘要:13.6.4g铜与60mL浓度为8mol/L的硝酸溶液充分反应.剩余溶液中含H+为nmol.此时溶液中含NO3-的物质的量为( ) A.0.31mol B.0.28mol C.mol D.mol
网址:http://m.1010jiajiao.com/timu3_id_129025[举报]
6.4g铜与60mL浓度为8mol/L的硝酸溶液充分反应,剩余溶液中含H+为nmol,此时溶液中含NO3-的物质的量为
- A.0.31mol
- B.0.28mol
- C.(0.4+n)mol
- D.(0.2+n)mol
6.4g铜与60mL浓度为8mol/L的硝酸溶液充分反应,剩余溶液中含H+为nmol,此时溶液中含NO3-的物质的量为
[ ]
A.0.31mol
B.0.28mol
C.(0.4+n)mol
D.(0.2+n)mol
查看习题详情和答案>>
B.0.28mol
C.(0.4+n)mol
D.(0.2+n)mol
(2011?香坊区二模)某校化学活动小组的同学欲用氧化铜、铁粉和稀硫酸为原料制备金属铜.
[设计与实验]实验过程和相应的现象如图所示: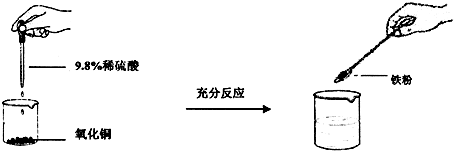
[交流与讨论]
(1)学生甲最终实验得到固体的成分是
(2)学生丙在加入铁粉后,发生反应的化学方程式:
(3)三位同学中制得铜质量最多的是
查看习题详情和答案>>
[设计与实验]实验过程和相应的现象如图所示:

| 学生甲 | 学生乙 | 学生丙 | |
| 氧化铜的质量(g) | 8 | 8 | 8 |
| 9.8%稀硫酸的质量(g) | 50 | 100 | 150 |
| 铁粉的质量(g) | 5.6 | 5.6 | 5.6 |
| 加入铁粉后的现象 | 有红色和黑色固体 | 有红色固体 | 有红色固体 |
(1)学生甲最终实验得到固体的成分是
CuO、Cu、Fe
CuO、Cu、Fe
;(2)学生丙在加入铁粉后,发生反应的化学方程式:
Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=FeSO4+Cu;
Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=FeSO4+Cu;
;(3)三位同学中制得铜质量最多的是
乙
乙
同学.你的分析理由是8g氧化铜中含铜6.4g.甲实验中的氧化铜过量,加入5.6g铁,只能置换出3.2g铜;乙实验中,氧化铜、硫酸和铁均恰好完全反应,生成6.4g铜;丙实验中的硫酸过量,加入铁粉后,有一部分铁与硫酸反应生成硫酸亚铁,一部分铁与硫酸铜反应置换出铜,所以得到铜的实际质量小于6.4g,所以乙得到的铜最多
8g氧化铜中含铜6.4g.甲实验中的氧化铜过量,加入5.6g铁,只能置换出3.2g铜;乙实验中,氧化铜、硫酸和铁均恰好完全反应,生成6.4g铜;丙实验中的硫酸过量,加入铁粉后,有一部分铁与硫酸反应生成硫酸亚铁,一部分铁与硫酸铜反应置换出铜,所以得到铜的实际质量小于6.4g,所以乙得到的铜最多
.