网址:http://m.1010jiajiao.com/timu3_id_126920[举报]
 (2013?川汇区三模)酸、碱、盐和氧化物的知识是初中化学重要的基础知识,以下是同学们对相关知识进行探究的过程.
(2013?川汇区三模)酸、碱、盐和氧化物的知识是初中化学重要的基础知识,以下是同学们对相关知识进行探究的过程.(1)酸和碱的组成中都含有氢元素,如图是氢在元素周期表中的一些信息,下列对图中信息的理解或应用错误的是
①A表示氢原子核中含有一个质子 ②B是元素的符号 ③C是元素的名称 ④D是原子的质量
(2)盐酸,硫酸和其他的酸都有相似的化学性质,如:它们都能使酸碱指示剂变色,它们都
(3)氢氧化钠、氯化钙、硫酸铜等物质的水溶液能导电,但是它们的固体缺不能导电,这是为什么?
(4)水垢主要是由氢氧化镁和碳酸钙组成的混合物,同学们分别用稀盐酸和稀硫酸来除去水垢,发现用稀盐酸很快就能将水垢除去,但是用稀硫酸除水垢时,反应会逐渐停止.你认为稀硫酸不能将水垢完全除尽的原因是
(5)为了测定水垢中的碳酸钙的含量,同学们称取10.0g水垢放入烧杯中,分4次将稀盐酸向烧杯中加入,测得数据如下表:
| 未加稀盐酸时 | 第一次加入10.0g稀盐酸 | 第二次加入10.0g稀盐酸 | 第三次加入10.0g稀盐酸 | 第四次加入10.0g稀盐酸 | |
| 烧杯中物质总质量 | 10.0g | 18.9g | 27.8g | 36.7g | 46.7g |
 (2013?西华县二模)酸、碱、盐是几类有广泛用途的重要化合物.
(2013?西华县二模)酸、碱、盐是几类有广泛用途的重要化合物.(1)酸和碱在组成和性质方面有很多共同的特点,请任写出其中的一条.
(2)氢氧化钙是一种常见的碱,列举其在生产、生活中的一种用途.
(3)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如右图)的溶液,他们对此产生了兴趣.
提出问题:这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种.为了确定该药品,他们首先进行了理论分析:
①小明根据标签上的组成元素认为一定不可能是
②小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是:
设计实验:为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验.
| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液 | 出现白色沉淀 |
| 静置一段时间后,倾去上层清液,向沉淀中滴加稀盐酸 | 白色沉淀全部溶解,并产生大量气泡 |
实验反思:④小强认为上述设计实验还可简化,也能达到目的.小强的实验操作是:
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
 酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.
酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.(1)酸和碱的组成中都含有氢元素,右图是氢在元素周期表中的一些信息,下列说法中错误的是
A.氢元素属于非金属元素 B.氢原子核内质子数为1
C.氢原子的质量为1.008 D.氢原子的结构示意图为
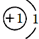
(2)盐酸和硫酸具有很多相似的化学性质,这是因为其溶液中都含有
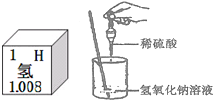
(3)小华同学打开盛放浓硫酸和浓盐酸的试剂瓶盖后,立即就能把它们区分开来,这是为什么?
(4)在进行酸碱中和反应的实验时,小明同学向烧杯中的氢氧化钠溶液滴加稀硫酸,一会儿发现由于忘记了滴加酚酞指示剂,因而无法确定稀硫酸与氢氧化钠是否恰好完全反应.
①同学们对溶质的成分提出了自己的看法:
小贝同学说:溶质除了硫酸钠还有氢氧化钠;小华同学说:溶质除了硫酸钠还有稀硫酸;小明同学说:溶质
②为了证明大家的猜想,老师取出少量反应后的溶液于一支试管中,并向试管中滴加几滴酚酞溶液,振荡,观察到溶液无明显变化. 则这三位同学的猜想中不正确的是
(5)小钢同学要配制70g溶质质量分数为5.4%的氯化铜溶液,经计算,他需要称量氯化铜的质量为
氯化铜溶液是蓝色的溶液,氯化铜溶液中主要含有Cu2+、Clˉ和水分子.某探究小组为探究氯化铜溶液中的哪种微粒能使氯化铜溶液显蓝色,设计了如下实验方案,得出了初步结论.请填写下表中的实验结论:
| 实 验 操 作 | 实验现象 | 实 验 结 论 |
| 取少量氯化钠固体,放入 试管中,加水,振荡 |
固体溶解, 溶液呈无色 |
氯化铜溶液中的Cu2+能使溶液显蓝色(或Clˉ和水分子不能使氯化铜溶液显蓝); 氯化铜溶液中的Cu2+能使溶液显蓝色(或Clˉ和水分子不能使氯化铜溶液显蓝); |
酸、碱、盐是几类有广泛用途的重要化合物.
(1)酸和碱在组成和性质方面有很多共同的特点,请任写出其中的一条.
(2)氢氧化钙是一种常见的碱,列举其在生产、生活中的一种用途.
(3)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如右图)的溶液,他们对此产生了兴趣.
提出问题:这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种.为了确定该药品,他们首先进行了理论分析:
①小明根据标签上的组成元素认为一定不可能是 (提示:只有其中一种).
②小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是:
设计实验:为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验.
| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液 | 出现白色沉淀 |
| 静置一段时间后,倾去上层清液,向沉淀中滴加稀盐酸 | 白色沉淀全部溶解,并产生大量气泡 |
实验反思:④小强认为上述设计实验还可简化,也能达到目的.小强的实验操作是:
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
 查看习题详情和答案>>
查看习题详情和答案>>
酸、碱、盐和氧化物的知识是初中化学重要的基础知识,以下是同学们对相关知识进行探究的过程.
(1)酸和碱的组成中都含有氢元素,如图是氢在元素周期表中的一些信息,下列对图中信息的理解或应用错误的是 .
①A表示氢原子核中含有一个质子 ②B是元素的符号 ③C是元素的名称 ④D是原子的质量
(2)盐酸,硫酸和其他的酸都有相似的化学性质,如:它们都能使酸碱指示剂变色,它们都 ;浓硫酸有 ,故可做干燥剂,但是浓硫酸不能干燥氨气,因为氨气能与硫酸反应,生成硫酸铵.该反应的化学方程式为
(3)氢氧化钠、氯化钙、硫酸铜等物质的水溶液能导电,但是它们的固体缺不能导电,这是为什么?
(4)水垢主要是由氢氧化镁和碳酸钙组成的混合物,同学们分别用稀盐酸和稀硫酸来除去水垢,发现用稀盐酸很快就能将水垢除去,但是用稀硫酸除水垢时,反应会逐渐停止.你认为稀硫酸不能将水垢完全除尽的原因是
(5)为了测定水垢中的碳酸钙的含量,同学们称取10.0g水垢放入烧杯中,分4次将稀盐酸向烧杯中加入,测得数据如下表:
| | 未加稀盐酸时 | 第一次加入10.0g稀盐酸 | 第二次加入10.0g稀盐酸 | 第三次加入10.0g稀盐酸 | 第四次加入10.0g稀盐酸 |
| 烧杯中物质总质量 | 10.0g | 18.9g | 27.8g | 36.7g | 46.7g |
 查看习题详情和答案>>
查看习题详情和答案>>