摘要:2.钠原子与钠离子在结构上不相同的是( ) 中考资源网 A.核电荷数 B.质子数 C.电子层数 D.中子数
网址:http://m.1010jiajiao.com/timu3_id_126402[举报]
下表是部分元素的原子结构示意图、主要化合价等信息:
(1)写出由铝元素与氯元素组成化合物的化学式 ;
(2)上表中各元素的最高正化合价与原子最外层电子数的关系是 (填“相等”或“不相等”).
(3)钠元素属于 (填“金属”或“非金属”),钠离子符号 ;氟原子在化学反应中易 电子(填“得”或“失”);原子的最外层电子数与元素的化学性质关系密切,在表中同一纵行的元素化学性质
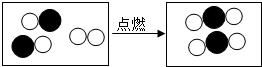
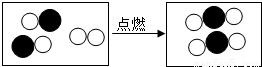
(4)如图形象地表示了某化学反应前后分子的变化.其中“ ”碳原子,“
”碳原子,“ ”表示氧原子,则该反应的化学方程式为: ;
”表示氧原子,则该反应的化学方程式为: ;
 查看习题详情和答案>>
查看习题详情和答案>>
| 第二周期 | 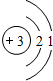 Li Li |
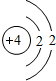 Be Be |
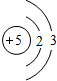 B B |
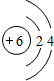 C C |
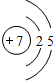 N N |
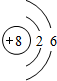 O O |
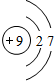 F F |
| 主要 化合价 |
+1 | +2 | +3 | +4,-4 | +5,-3 | -2 | -1 |
| 第三周期 |  Na Na |
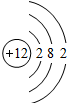 Mg Mg |
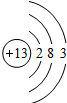 Al Al |
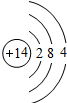 Si Si |
 P P |
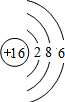 S S |
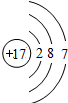 Cl Cl |
| 主要 化合价 |
+1 | +2 | +3 | +4,-4 | +5,-3 | +6,-2 | +7,-1 |
(2)上表中各元素的最高正化合价与原子最外层电子数的关系是
(3)钠元素属于
(4)如图形象地表示了某化学反应前后分子的变化.其中“
 ”碳原子,“
”碳原子,“ ”表示氧原子,则该反应的化学方程式为:
”表示氧原子,则该反应的化学方程式为: 查看习题详情和答案>>
查看习题详情和答案>>
下表是部分元素的原子结构示意图、主要化合价等信息:
| 第二周期 |  Li Li | 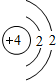 Be Be |  B B | 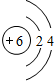 C C | 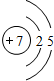 N N |  O O |  F F |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | -2 | -1 |
| 第三周期 | 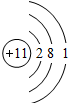 Na Na |  Mg Mg | 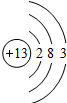 Al Al | 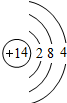 Si Si | 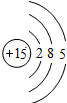 P P | 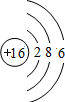 S S |  Cl Cl |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | +6,-2 | +7,-1 |
(2)上表中各元素的最高正化合价与原子最外层电子数的关系是______(填“相等”或“不相等”).
(3)钠元素属于______(填“金属”或“非金属”),钠离子符号______;氟原子在化学反应中易______电子(填“得”或“失”);原子的最外层电子数与元素的化学性质关系密切,在表中同一纵行的元素化学性质______
(4)如图形象地表示了某化学反应前后分子的变化.其中“
 ”碳原子,“
”碳原子,“ ”表示氧原子,则该反应的化学方程式为:______;
”表示氧原子,则该反应的化学方程式为:______; 查看习题详情和答案>>
查看习题详情和答案>>
下表是部分元素的原子结构示意图、主要化合价等信息:
(1)写出由铝元素与氯元素组成化合物的化学式 ;
(2)上表中各元素的最高正化合价与原子最外层电子数的关系是 (填“相等”或“不相等”).
(3)钠元素属于 (填“金属”或“非金属”),钠离子符号 ;氟原子在化学反应中易 电子(填“得”或“失”);原子的最外层电子数与元素的化学性质关系密切,在表中同一纵行的元素化学性质
(4)如图形象地表示了某化学反应前后分子的变化.其中“ ”碳原子,“
”碳原子,“ ”表示氧原子,则该反应的化学方程式为: ;
”表示氧原子,则该反应的化学方程式为: ;
 查看习题详情和答案>>
查看习题详情和答案>>
| 第二周期 | 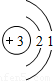 Li Li | 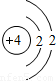 Be Be | 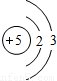 B B |  C C |  N N |  O O | 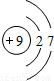 F F |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | -2 | -1 |
| 第三周期 | 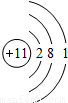 Na Na |  Mg Mg | 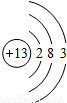 Al Al |  Si Si | 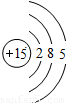 P P | 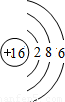 S S | 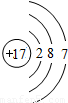 Cl Cl |
| 主要 化合价 | +1 | +2 | +3 | +4,-4 | +5,-3 | +6,-2 | +7,-1 |
(2)上表中各元素的最高正化合价与原子最外层电子数的关系是 (填“相等”或“不相等”).
(3)钠元素属于 (填“金属”或“非金属”),钠离子符号 ;氟原子在化学反应中易 电子(填“得”或“失”);原子的最外层电子数与元素的化学性质关系密切,在表中同一纵行的元素化学性质
(4)如图形象地表示了某化学反应前后分子的变化.其中“
 ”碳原子,“
”碳原子,“ ”表示氧原子,则该反应的化学方程式为: ;
”表示氧原子,则该反应的化学方程式为: ; 查看习题详情和答案>>
查看习题详情和答案>>
21、(1)请在横线上用恰当的化学用语表示:
①2个氧分子
③硝酸钾的化学式
(2) 氯化钠有着广泛用途,不但是重要的调味品,又是重要的工业原料.
①通过晾晒海水或煮盐井水、盐湖水等均可得到含有较多杂质的氯化钠晶体--粗盐,这种方法属于
②钠与氯气反应时,每个钠原子失去
③氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水(Cl2+2NaOH=NaCl+NaClO+H2O),工业上常用氯气和石灰水反应制漂白粉,其反应原理与上述反应相同,请写出制漂白粉的化学方程式
(3) 下图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和部分生成物 省略).
省略).
请按下列要求填空:
①物质a主要成分的化学式是
②物质b主要成分中阳离子是
③物质c(C6H12O6)所属类别是
④写出由CO2生成物质d的化学反应方程式
⑤标出物质e化学式中带点元素的化合价
查看习题详情和答案>>
①2个氧分子
2O2
,②硫酸根离子SO42-
,③硝酸钾的化学式
KNO3
.(2) 氯化钠有着广泛用途,不但是重要的调味品,又是重要的工业原料.
①通过晾晒海水或煮盐井水、盐湖水等均可得到含有较多杂质的氯化钠晶体--粗盐,这种方法属于
物理
变化(填“物理”或“化学”).粗盐经过溶解
、过滤、蒸发
可得到初步提纯.②钠与氯气反应时,每个钠原子失去
一
个电子形成钠离子(Na+),每个氯原子得到一
个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成NaCl③氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水(Cl2+2NaOH=NaCl+NaClO+H2O),工业上常用氯气和石灰水反应制漂白粉,其反应原理与上述反应相同,请写出制漂白粉的化学方程式
2Cl2+2Ca(OH)2=CaCl2+2H2O+Ca(ClO)2
.(3) 下图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和部分生成物
 省略).
省略).请按下列要求填空:
①物质a主要成分的化学式是
CH4
;②物质b主要成分中阳离子是
Ca2+
;③物质c(C6H12O6)所属类别是
有机化合物
该物质中C、H、O三种元素的质量比是6:1:8
;④写出由CO2生成物质d的化学反应方程式
CO2+H2O=H2CO3
.⑤标出物质e化学式中带点元素的化合价
+1价
.(11分)探秘海滩上的物质
在海滩上,你能见到各种各样的物质,除海洋生物外,最常见的有海沙、贝壳和海水。虽然它们性质和用途各异,但是元素组成的角度看,这些物质仅是由氧、碳、氢、率、钙等有限的几种元素组成的。
原子是构成物质的“基石”。一种粒子,可以构成最简单的单质,但更多的是跟其它原子结合成各种化合物,请回答:
(1)从化学的视角认识物质
①海沙是由石英和贝壳小碎片组成,石英的主要成分是(用化学符号表示,下同) ,贝壳的主要成分是 。
②请写出一种同时符合下列两个条件的化合物的名称和化学式 。
(Ⅰ)由氧、硅、氢、碳、钙五种元素中的三种组成;
(Ⅱ)按组成分类,与①中两种物质的主要成分类型不同。

③海水中含有多种无机盐,各离子的含量如图所示,其中由硫酸根离子和镁离子构成盐的化学式是 。假设海水中无机盐的含量为3.5%。钾离子全部以氯化钾的形式存在,则Wg海水中含有氯化钾质量的计算公式为 。
④各地海水中盐的含量并不完全相同,在长江入海口处,海水中盐的含量较低,原因是 。
⑤食用低钠盐可预防高血压,低钠盐是在氯化钠中添加了适量的氯化钾,氯化钾除了有咸味外,还带有苦味,从物质构成的角度看,氯化钾有苦味可能是 造成的。
(2)用化学的方法改造物质
海水中含有丰富的镁元素,目前工业上绝大多数金属镁是从海水中提取的,其生产流程如下:
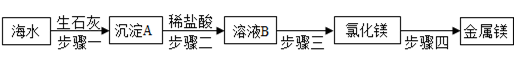
①步骤一中发生反应的化学方程式为 , 。
②上述生产流程中发生的反应,没有涉及到的基本反应类型是 。
③在步骤一中,分离出沉淀A的方法是 。
在海滩上,你能见到各种各样的物质,除海洋生物外,最常见的有海沙、贝壳和海水。虽然它们性质和用途各异,但是元素组成的角度看,这些物质仅是由氧、碳、氢、率、钙等有限的几种元素组成的。
原子是构成物质的“基石”。一种粒子,可以构成最简单的单质,但更多的是跟其它原子结合成各种化合物,请回答:
(1)从化学的视角认识物质
①海沙是由石英和贝壳小碎片组成,石英的主要成分是(用化学符号表示,下同) ,贝壳的主要成分是 。
②请写出一种同时符合下列两个条件的化合物的名称和化学式 。
(Ⅰ)由氧、硅、氢、碳、钙五种元素中的三种组成;
(Ⅱ)按组成分类,与①中两种物质的主要成分类型不同。

③海水中含有多种无机盐,各离子的含量如图所示,其中由硫酸根离子和镁离子构成盐的化学式是 。假设海水中无机盐的含量为3.5%。钾离子全部以氯化钾的形式存在,则Wg海水中含有氯化钾质量的计算公式为 。
④各地海水中盐的含量并不完全相同,在长江入海口处,海水中盐的含量较低,原因是 。
⑤食用低钠盐可预防高血压,低钠盐是在氯化钠中添加了适量的氯化钾,氯化钾除了有咸味外,还带有苦味,从物质构成的角度看,氯化钾有苦味可能是 造成的。
(2)用化学的方法改造物质
海水中含有丰富的镁元素,目前工业上绝大多数金属镁是从海水中提取的,其生产流程如下:

①步骤一中发生反应的化学方程式为 , 。
②上述生产流程中发生的反应,没有涉及到的基本反应类型是 。
③在步骤一中,分离出沉淀A的方法是 。