网址:http://m.1010jiajiao.com/timu3_id_126110[举报]
氢氧化钠是一种重要的化工原料,具有广泛的应用,回答下列问题:
(1)往氢氧化钠溶液中逐滴加稀盐酸至过量,此时溶液中的溶质除氯化钠外还有______.
(2)敞口放置的氢氧化钠溶液容易变质,证明其变质的方法是:用干净的试管取少量敞口放置的氢氧化钠溶液,再加入适量的______,若观察到______,则该溶液已经变质.
(3)航天员穿的舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它可能具有的化学性质是______.
A.与二氧化碳反应 B.与盐酸反应
C.与氧化铜反应 D.与氯化铜溶液反应
(4)某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗40g氢氧化钠溶液,洗涤后的溶液呈中性,这一定量石油产品中含硫酸______g.
查看习题详情和答案>>
(4分)氢氧化钴[Co(OH)2] 可作涂料和清漆的干燥剂,其制备方法是:把金属钴与稀盐酸反应制得氯化钴(CoCl2),再将氯化钴溶液与氢氧化钠溶液反应制得氢氧化钴。
查阅资料:氯化钴溶液是粉红色,氢氧化钴是难溶于水的粉红色固体。请回答:
(1)金属钴与稀盐酸反应的化学方程式为 。
(2)氯化钴溶液与氢氧化钠溶液反应的现象是 ,化学方程式为 。
(3)下列说法正确的是 。
A.钴的金属活动性比铜的强
B.氢氧化钴可以干燥氯化氢气体
C.氯化钴溶液也能和石灰水反应
在“氢氧化钠的化学性质”实验探究课上,同学们做了氢氧化钠溶液与稀硫酸、氯化铜溶液之间反应的实验.为对本课产生的废液进行绿色排放,甲、乙两位同学对废液的成分进行探究和处理.请填空:
(1)甲同学取少量溶液样品,观察到样品澄清并呈浅蓝色.由此猜想,溶液中可能存在的离子为 .
(2)乙同学欲将废液处理为无色的中性溶液后再排放,他向废液中逐滴滴加氢氧化钠溶液,直至观察到 ,说明废液达到了该同学的排放要求.
查看习题详情和答案>>查阅资料:氯化钴溶液是粉红色,氢氧化钴是难溶于水的粉红色固体。请回答:
(1)金属钴与稀盐酸反应的化学方程式为 。
(2)氯化钴溶液与氢氧化钠溶液反应的现象是 ,化学方程式为 。
(3)下列说法正确的是 。
A.钴的金属活动性比铜的强
B.氢氧化钴可以干燥氯化氢气体
C.氯化钴溶液也能和石灰水反应
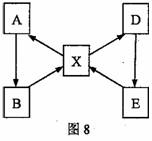
反应物、生成物及反应条件略去)。己知: ① 五种物质均含铜元素,且化合物中铜元素的化合价均为+ 2 ; ② A 为单质,在空气中加热后生成黑色物质 B ; ③ X 溶液与铁反应可得到 A ; ④ X 溶液与氯化钡溶液反应可得到 D ,同时有白色沉淀生成; ⑤ D 溶液中加入少量的氢氧化钠溶液得到 E 。结合信息推断:
(1)B 的化学式是______。
(2)D→E 的反应基本类型是____________; E 与某种酸反应可实现 E→X 转化,该酸的名称是____________。
(3)写出以下转化的化学方程式:
X→A : ________________________ ;
X→D : ________________________。