摘要:在日常生活中.许多的物质变化属于物理变化.如..等. 中考资源网 中\考资源网
网址:http://m.1010jiajiao.com/timu3_id_125201[举报]
鸡蛋是日常生活中常见的食品,某研究小组同学欲从化学的角度来进一步研究“鸡蛋”:
【实验探究一】同学们发现鸡蛋放置时间太久会变质并会产生一股臭味,这是什么原因呢?
查阅资料:
①鸡蛋久置后会变质产生硫化氢(H2S)气体;硫化氢气体有剧毒,密度比空气大,能溶于水,溶于水后呈酸性.
②实验室可用硫化亚铁(化学式为FeS)固体和稀硫酸在常温下反应来制取硫化氢气体,同时生成硫酸亚铁;
同学们在实验室制取并收集了一瓶硫化氢气体,回答下列问题: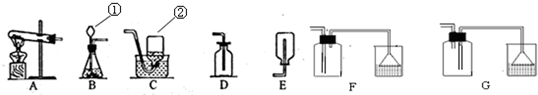
(1)写出有标号的仪器的名称
①
(2)H2S气体中的硫元素的化合价为
【实验探究二】鸡蛋壳的成分
(注意:以下实验均假设鸡蛋壳中除碳酸钙以外的其他成分不能与酸反应,也不溶于水)
(3)小李同学查知鸡蛋壳的主要成份是碳酸钙,他用镊子取少许鸡蛋壳样品在酒精灯上灼烧,一开始闻到一股烧焦羽毛气味,说明内膜有
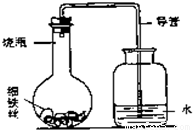
(4)为了进一步测定蛋壳中碳酸钙的质量分数,小刚同学进行了如下实验.
称量G装置质量为50.00g,按下图组装后,将10.00g蛋壳样品(已洗净、干燥并捣碎)放入锥形瓶中,加入足量稀盐酸,待锥形瓶中不再产生气泡时,打开弹簧夹C,从导管A处缓缓鼓入空气,一段时间后称量装置G质量为52.64g(不考虑原装置内空气对实验的影响).
回答下列问题:
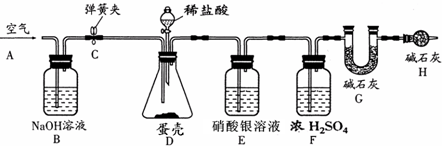
加入样品前还应
(5)小勇同学重新设计了一种方案,将10.00g蛋壳样品(已洗净、干燥并捣碎)放在烧杯里,然后往烧杯中加入足量稀盐酸,蛋壳部分溶解,并产生大量气泡,实验过程和测定的相关实验数据如下所示:

小勇的实验测得蛋壳中碳酸钙的质量分数为
查看习题详情和答案>>
【实验探究一】同学们发现鸡蛋放置时间太久会变质并会产生一股臭味,这是什么原因呢?
查阅资料:
①鸡蛋久置后会变质产生硫化氢(H2S)气体;硫化氢气体有剧毒,密度比空气大,能溶于水,溶于水后呈酸性.
②实验室可用硫化亚铁(化学式为FeS)固体和稀硫酸在常温下反应来制取硫化氢气体,同时生成硫酸亚铁;
同学们在实验室制取并收集了一瓶硫化氢气体,回答下列问题:

(1)写出有标号的仪器的名称
①
长颈漏斗
长颈漏斗
②集气瓶
集气瓶
(2)H2S气体中的硫元素的化合价为
-2
-2
,写出实验室制取硫化氢气体的化学方程式FeS+H2SO4=FeSO4+H2S↑
FeS+H2SO4=FeSO4+H2S↑
,该反应属于复分解
复分解
反应(填基本反应类型),制取该气体应选用的发生装置为B
B
(填字母),收集硫化氢气体最好选用的装置为F
F
(填字母),多余的气体可用氢氧化钠
氢氧化钠
溶液来吸收.【实验探究二】鸡蛋壳的成分
(注意:以下实验均假设鸡蛋壳中除碳酸钙以外的其他成分不能与酸反应,也不溶于水)
(3)小李同学查知鸡蛋壳的主要成份是碳酸钙,他用镊子取少许鸡蛋壳样品在酒精灯上灼烧,一开始闻到一股烧焦羽毛气味,说明内膜有
蛋白质
蛋白质
,继续灼烧后,看到蛋壳边变白,产生该白色物质的化学反应方程式为CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
,将充分灼烧后的蛋壳投入蒸馏水中,滴入无色酚酞试液,试液变为
| ||
红
红
色,发生反应的化学方程式为CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
.(4)为了进一步测定蛋壳中碳酸钙的质量分数,小刚同学进行了如下实验.
称量G装置质量为50.00g,按下图组装后,将10.00g蛋壳样品(已洗净、干燥并捣碎)放入锥形瓶中,加入足量稀盐酸,待锥形瓶中不再产生气泡时,打开弹簧夹C,从导管A处缓缓鼓入空气,一段时间后称量装置G质量为52.64g(不考虑原装置内空气对实验的影响).
回答下列问题:

加入样品前还应
从导管A处缓缓鼓入空气
从导管A处缓缓鼓入空气
,装置D中反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
,装置E的作用是吸收氯化氢气体
吸收氯化氢气体
,反应结束后打开弹簧夹C,缓缓鼓入空气的目的是生成二氧化碳全部进入到G装置中
生成二氧化碳全部进入到G装置中
,装置B的作用是吸收空气中二氧化碳
吸收空气中二氧化碳
,若缺少H装置,则测得的碳酸钙的质量分数将偏大
大
.小刚的实验测得蛋壳中碳酸钙的质量分数为60%
60%
.(5)小勇同学重新设计了一种方案,将10.00g蛋壳样品(已洗净、干燥并捣碎)放在烧杯里,然后往烧杯中加入足量稀盐酸,蛋壳部分溶解,并产生大量气泡,实验过程和测定的相关实验数据如下所示:

小勇的实验测得蛋壳中碳酸钙的质量分数为
57%
57%
,小刚认为小勇的实验过程有一个明显的缺陷会导致测得的碳酸钙的含量偏低,这个缺陷是未洗涤直接烘干就称量造成结果偏大,从而使得碳酸钙的含量偏低
未洗涤直接烘干就称量造成结果偏大,从而使得碳酸钙的含量偏低
.对生活中常见金属的有关问题探究:
人类从石器时代进入青铜器时代,继而进入铁器时代;前两个世纪中钢铁产量是衡量国家工业和经济发展的标志.可见金属材料长期以来一直被广泛地应用着.对金属材料的探究要用到许多化学知识.
(1)“金属之最”:完成(1)~(2)的空格,并以此为例,再另外写出两个“金属之最”.
①目前世界上年产量最高的金属是
②地壳中含量最多的金属是
③
(2)“变废为宝,回收利用”:某厂的废液中含有H2SO4和CuSO4,为了防止废酸和CuSO4污染环境,厂家设计用含铁的废弃物回收金属铜,同时生产重要的化工原料硫酸亚铁晶体,设计原理如图所示:
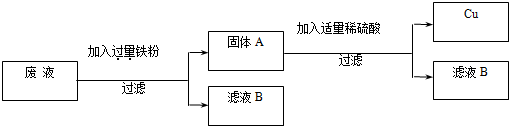
请你根据上述设计方案写出有关化学方程式: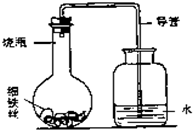
(3)“锈蚀条件的探究”:某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
①导管中水面为什么会上升?
②上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶号):
③影响铁生锈的因素有:
(4)“金属的防护”:对如何防止你的自行车的钢圈生锈提出两种方案.
(5)“金属的冶炼”:某钢铁厂日产含4%杂质的生铁2240吨.问:需要含Fe2O3质量分数为80%的赤铁矿石多少吨?
查看习题详情和答案>>
人类从石器时代进入青铜器时代,继而进入铁器时代;前两个世纪中钢铁产量是衡量国家工业和经济发展的标志.可见金属材料长期以来一直被广泛地应用着.对金属材料的探究要用到许多化学知识.
(1)“金属之最”:完成(1)~(2)的空格,并以此为例,再另外写出两个“金属之最”.
①目前世界上年产量最高的金属是
铁
铁
;②地壳中含量最多的金属是
铝
铝
;③
熔点最低的金属是汞
熔点最低的金属是汞
;④熔点最高的金属是钨
熔点最高的金属是钨
.(2)“变废为宝,回收利用”:某厂的废液中含有H2SO4和CuSO4,为了防止废酸和CuSO4污染环境,厂家设计用含铁的废弃物回收金属铜,同时生产重要的化工原料硫酸亚铁晶体,设计原理如图所示:

请你根据上述设计方案写出有关化学方程式:
Fe+H2SO4 ═FeSO4+H2↑
Fe+H2SO4 ═FeSO4+H2↑
;Fe+CuSO4═Cu+FeSO4
Fe+CuSO4═Cu+FeSO4
.
(3)“锈蚀条件的探究”:某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
| 时间/小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(盛完全浸没在食盐水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
铁生锈时消耗氧气,使瓶内压强降低
铁生锈时消耗氧气,使瓶内压强降低
.②上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶号):
B>C>A=D
B>C>A=D
.③影响铁生锈的因素有:
水和氧气,有盐溶液速度最快.
水和氧气,有盐溶液速度最快.
.(4)“金属的防护”:对如何防止你的自行车的钢圈生锈提出两种方案.
镀一层金属或涂油
镀一层金属或涂油
.(5)“金属的冶炼”:某钢铁厂日产含4%杂质的生铁2240吨.问:需要含Fe2O3质量分数为80%的赤铁矿石多少吨?
鸡蛋是日常生活中常见的食品,某研究小组同学欲从化学的角度来进一步研究“鸡蛋”:
【实验探究一】同学们发现鸡蛋放置时间太久会变质并会产生一股臭味,这是什么原因呢?
查阅资料:
①鸡蛋久置后会变质产生硫化氢(H2S)气体;硫化氢气体有剧毒,密度比空气大,能溶于水,溶于水后呈酸性.
②实验室可用硫化亚铁(化学式为FeS)固体和稀硫酸在常温下反应来制取硫化氢气体,同时生成硫酸亚铁;
同学们在实验室制取并收集了一瓶硫化氢气体,回答下列问题: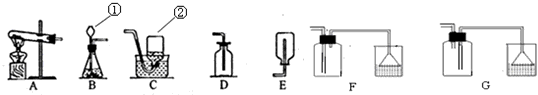
(1)写出有标号的仪器的名称
①________ ②________
(2)H2S气体中的硫元素的化合价为________,写出实验室制取硫化氢气体的化学方程式________,该反应属于________反应(填基本反应类型),制取该气体应选用的发生装置为________(填字母),收集硫化氢气体最好选用的装置为________(填字母),多余的气体可用________溶液来吸收.
【实验探究二】鸡蛋壳的成分
(注意:以下实验均假设鸡蛋壳中除碳酸钙以外的其他成分不能与酸反应,也不溶于水)
(3)小李同学查知鸡蛋壳的主要成份是碳酸钙,他用镊子取少许鸡蛋壳样品在酒精灯上灼烧,一开始闻到一股烧焦羽毛气味,说明内膜有________,继续灼烧后,看到蛋壳边变白,产生该白色物质的化学反应方程式为________,将充分灼烧后的蛋壳投入蒸馏水中,滴入无色酚酞试液,试液变为________色,发生反应的化学方程式为________.
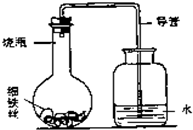
(4)为了进一步测定蛋壳中碳酸钙的质量分数,小刚同学进行了如下实验.
称量G装置质量为50.00g,按下图组装后,将10.00g蛋壳样品(已洗净、干燥并捣碎)放入锥形瓶中,加入足量稀盐酸,待锥形瓶中不再产生气泡时,打开弹簧夹C,从导管A处缓缓鼓入空气,一段时间后称量装置G质量为52.64g(不考虑原装置内空气对实验的影响).
回答下列问题:

加入样品前还应________,装置D中反应的化学方程式为________,装置E的作用是________,反应结束后打开弹簧夹C,缓缓鼓入空气的目的是________,装置B的作用是________,若缺少H装置,则测得的碳酸钙的质量分数将偏________.小刚的实验测得蛋壳中碳酸钙的质量分数为________.
(5)小勇同学重新设计了一种方案,将10.00g蛋壳样品(已洗净、干燥并捣碎)放在烧杯里,然后往烧杯中加入足量稀盐酸,蛋壳部分溶解,并产生大量气泡,实验过程和测定的相关实验数据如下所示:

小勇的实验测得蛋壳中碳酸钙的质量分数为________,小刚认为小勇的实验过程有一个明显的缺陷会导致测得的碳酸钙的含量偏低,这个缺陷是________.
查看习题详情和答案>>
 对生活中常见金属的有关问题探究:
对生活中常见金属的有关问题探究:
人类从石器时代进入青铜器时代,继而进入铁器时代;前两个世纪中钢铁产量是衡量国家工业和经济发展的标志.可见金属材料长期以来一直被广泛地应用着.对金属材料的探究要用到许多化学知识.
(1)“金属之最”:完成(1)~(2)的空格,并以此为例,再另外写出两个“金属之最”.
①目前世界上年产量最高的金属是______;
②地壳中含量最多的金属是______;
③______;④______.
(2)“变废为宝,回收利用”:某厂的废液中含有H2SO4和CuSO4,为了防止废酸和CuSO4污染环境,厂家设计用含铁的废弃物回收金属铜,同时生产重要的化工原料硫酸亚铁晶体,设计原理如图所示:
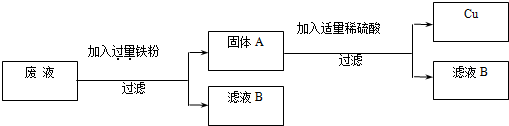
请你根据上述设计方案写出有关化学方程式:______;______.
(3)“锈蚀条件的探究”:某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
| 时间/小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(盛完全浸没在食盐水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
②上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶号):______.
③影响铁生锈的因素有:______.
(4)“金属的防护”:对如何防止你的自行车的钢圈生锈提出两种方案.______.
(5)“金属的冶炼”:某钢铁厂日产含4%杂质的生铁2240吨.问:需要含Fe2O3质量分数为80%的赤铁矿石多少吨? 查看习题详情和答案>>
对生活中常见金属的有关问题探究:
人类从石器时代进入青铜器时代,继而进入铁器时代;前两个世纪中钢铁产量是衡量国家工业和经济发展的标志.可见金属材料长期以来一直被广泛地应用着.对金属材料的探究要用到许多化学知识.
(1)“金属之最”:完成(1)~(2)的空格,并以此为例,再另外写出两个“金属之最”.
①目前世界上年产量最高的金属是______;
②地壳中含量最多的金属是______;
③______;④______.
(2)“变废为宝,回收利用”:某厂的废液中含有H2SO4和CuSO4,为了防止废酸和CuSO4污染环境,厂家设计用含铁的废弃物回收金属铜,同时生产重要的化工原料硫酸亚铁晶体,设计原理如图所示:
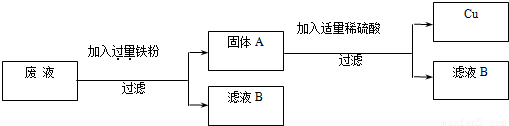
请你根据上述设计方案写出有关化学方程式:______;______.
(3)“锈蚀条件的探究”:某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
①导管中水面为什么会上升?______.
②上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶号):______.
③影响铁生锈的因素有:______.
(4)“金属的防护”:对如何防止你的自行车的钢圈生锈提出两种方案.______.
(5)“金属的冶炼”:某钢铁厂日产含4%杂质的生铁2240吨.问:需要含Fe2O3质量分数为80%的赤铁矿石多少吨?
 查看习题详情和答案>>
查看习题详情和答案>>
人类从石器时代进入青铜器时代,继而进入铁器时代;前两个世纪中钢铁产量是衡量国家工业和经济发展的标志.可见金属材料长期以来一直被广泛地应用着.对金属材料的探究要用到许多化学知识.
(1)“金属之最”:完成(1)~(2)的空格,并以此为例,再另外写出两个“金属之最”.
①目前世界上年产量最高的金属是______;
②地壳中含量最多的金属是______;
③______;④______.
(2)“变废为宝,回收利用”:某厂的废液中含有H2SO4和CuSO4,为了防止废酸和CuSO4污染环境,厂家设计用含铁的废弃物回收金属铜,同时生产重要的化工原料硫酸亚铁晶体,设计原理如图所示:

请你根据上述设计方案写出有关化学方程式:______;______.
(3)“锈蚀条件的探究”:某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
| 时间/小时 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | |
| A瓶(盛干燥铁丝) | |||||||
| B瓶(盛沾了食盐水的铁丝) | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 | |
| C瓶(盛沾了清水的铁丝) | 0.3 | 0.8 | 2.0 | 3.5 | |||
| D瓶(盛完全浸没在食盐水中的铁丝) |
②上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶号):______.
③影响铁生锈的因素有:______.
(4)“金属的防护”:对如何防止你的自行车的钢圈生锈提出两种方案.______.
(5)“金属的冶炼”:某钢铁厂日产含4%杂质的生铁2240吨.问:需要含Fe2O3质量分数为80%的赤铁矿石多少吨?
 查看习题详情和答案>>
查看习题详情和答案>>