摘要:(1)N2 + 3 H2==== 2 NH3 (2)⑤④①②③ (3)H2O + CO2 = H2CO3 2 CO+2 NO N2 +2 CO2
网址:http://m.1010jiajiao.com/timu3_id_124609[举报]
以焦炭,水,空气为原料制取氨气( NH 3)的主要反应有:
![]() ① C+ H2O(气)
① C+ H2O(气) ![]() CO+ H2 ② CO + H2O(气) CO2十 H2
CO+ H2 ② CO + H2O(气) CO2十 H2
![]() ③ N2+3 H2 2NH 3, 则参加反应的碳原子与生成氨气分子数之比为 ( )
③ N2+3 H2 2NH 3, 则参加反应的碳原子与生成氨气分子数之比为 ( )
A . 3 : 4 B. 3 : 2 C . 2 : 3 D . l : 2
查看习题详情和答案>>1909年化学家哈伯在实验室首次将氮气和氢气在一定条件下合成了氨(NH3).常温下,氨是一种无色有刺激性气味的气体,密度小于空气,极易溶解于水,氨和氧气在铂催化剂和一定温度下反应产生一氧化氮和水.
(1)从以上信息中你能总结出氨的物理性质是
(2)下图为实验室制取气体常使用的实验装置:
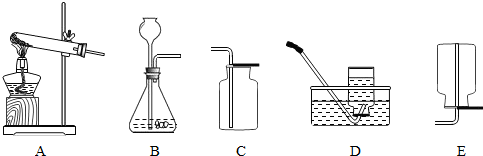
在实验室中,常用加热氯化铵(固体)和熟石灰(固体)混合物的方法制取氨气.
①采用上述方法制取氨气应选择
②同学们一致认为,选择C装置收集氨气不合理,理由是
(3)2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
用 、
、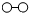 、
、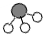 分别表示N2、H2、NH3.在催化剂表面(
分别表示N2、H2、NH3.在催化剂表面( 下图中表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
下图中表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
①观察上图,可发现合成氨反应过程的顺序为:E→
②综合以上五张图示,你能总结出的有关化学反应的一条结论是:
(4)某研究性学习小组尝试利用氨气进行“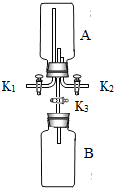 微粒的基本性质”的实验探究,实验过程如下:
微粒的基本性质”的实验探究,实验过程如下:
a.将干燥的集气瓶B充满与大气压强相等的干燥氯化氢气体并组装成如右图所示的实验装置(K3处于关闭状态至操作b完成为止);
b.通过调节活塞K1、K2,在干燥的集气瓶A中充满与大气压强相等的干燥氨气,其操作是:打开K1、K2,在
c.集满氨气后,关闭K1、K2,再打开K3,一段时间后两只集气瓶中都出现白烟(氯化氢气体与氨气反应产生氯化铵固体的细小颗粒).
①上述c步实验中出现的现象说明
②如果这两个瓶子是质地较软的塑料瓶,我们将会观察到塑料瓶变瘪了,原因
查看习题详情和答案>>
(1)从以上信息中你能总结出氨的物理性质是
密度小于空气(或常温下,氨是一种无色有刺激性气味的气体,极易溶解于水)
密度小于空气(或常温下,氨是一种无色有刺激性气味的气体,极易溶解于水)
(写出一条即可);(2)下图为实验室制取气体常使用的实验装置:

在实验室中,常用加热氯化铵(固体)和熟石灰(固体)混合物的方法制取氨气.
①采用上述方法制取氨气应选择
A
A
(填装置序号)作为气体的发生装置;②同学们一致认为,选择C装置收集氨气不合理,理由是
氨的密度比空气小
氨的密度比空气小
.(3)2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
用
 、
、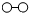 、
、 分别表示N2、H2、NH3.在催化剂表面(
分别表示N2、H2、NH3.在催化剂表面( 下图中表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
下图中表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
①观察上图,可发现合成氨反应过程的顺序为:E→
D
D
→A
A
→B
B
→C(在括号中填写其它三张图示的序号);②综合以上五张图示,你能总结出的有关化学反应的一条结论是:
化学变化中分子可分,原子不可分(或化学变化中,原子的个数和种类不变等)
化学变化中分子可分,原子不可分(或化学变化中,原子的个数和种类不变等)
.(4)某研究性学习小组尝试利用氨气进行“
 微粒的基本性质”的实验探究,实验过程如下:
微粒的基本性质”的实验探究,实验过程如下:a.将干燥的集气瓶B充满与大气压强相等的干燥氯化氢气体并组装成如右图所示的实验装置(K3处于关闭状态至操作b完成为止);
b.通过调节活塞K1、K2,在干燥的集气瓶A中充满与大气压强相等的干燥氨气,其操作是:打开K1、K2,在
K1
K1
(选填“K1”或“K2”)处导管口通入干燥的氨气;c.集满氨气后,关闭K1、K2,再打开K3,一段时间后两只集气瓶中都出现白烟(氯化氢气体与氨气反应产生氯化铵固体的细小颗粒).
①上述c步实验中出现的现象说明
氨气可与酸反应生成相应的铵盐
氨气可与酸反应生成相应的铵盐
.②如果这两个瓶子是质地较软的塑料瓶,我们将会观察到塑料瓶变瘪了,原因
气体被消耗生成了固体,瓶内压强小于外界大气压
气体被消耗生成了固体,瓶内压强小于外界大气压
.合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献.合成氨的工艺流程图如图1:

(1)合成氨需要的氮气来自空气,这一变化过程为
(2)制取氢气的反应过程为:C+H2O
CO+H2.上述化学方程式中表现氧化性的物质是
(3)写出N2、H2反应生成NH3的化学方程式
时,导出的混合气体恰好完全反应.
(4)将沸点不同的气体分离开来,常采用液化分离法.如,控制温度在-183℃时,可将空气中N2与O2分离.根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在
查看习题详情和答案>>

(1)合成氨需要的氮气来自空气,这一变化过程为
化学变化
化学变化
(填“物理变化”或“化学变化”),空气中氮气的体积分数约为78%
78%
.(2)制取氢气的反应过程为:C+H2O
| ||
H2O
H2O
(填化学式).(3)写出N2、H2反应生成NH3的化学方程式
N2+3H2
2NH3
| ||
| 高温高压 |
N2+3H2
2NH3
.已知同温同压下,相同数目的气体分子具有相同的气体体积,若要让氢气和氮气恰好完全反应,则需要氢气和氮气的体积比为:
| ||
| 高温高压 |
3:1
3:1
,若用如图2装置通过调节气体的流速达到控制两种气体的体积比的目的,当你所看到的现象是:瓶中两导管冒出气泡的速度氢气是氮气的三倍
瓶中两导管冒出气泡的速度氢气是氮气的三倍
时,导出的混合气体恰好完全反应.
(4)将沸点不同的气体分离开来,常采用液化分离法.如,控制温度在-183℃时,可将空气中N2与O2分离.根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在
-33.35
-33.35
℃.| 物质 | H2 | N2 | O2 | NH3 |
| 沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
(1)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3).反应的化学方程式 .
(2)用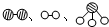 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序 (将下面五张图按反应过程顺序用序号排列).
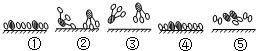
(3)表面化学对于化学工业很重要,它可以帮助我们了解不同的过程.
在潮湿的空气里,铁表面吸附了一层薄薄的水膜,同时由于空气O2的溶解,水膜呈中性.若空气中CO2溶解,水膜呈酸性,写出该反应的化学方程式 .
在汽车排气管上安装尾气净化装置,可使尾气中的CO和NO在催化剂表面发生反应,产生两种空气组成的气体,写出该反应的化学方程式 .
查看习题详情和答案>>
(1)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3).反应的化学方程式
(2)用
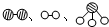 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序
分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序
(3)表面化学对于化学工业很重要,它可以帮助我们了解不同的过程.
在潮湿的空气里,铁表面吸附了一层薄薄的水膜,同时由于空气O2的溶解,水膜呈中性.若空气中CO2溶解,水膜呈酸性,写出该反应的化学方程式
在汽车排气管上安装尾气净化装置,可使尾气中的CO和NO在催化剂表面发生反应,产生两种空气组成的气体,写出该反应的化学方程式