摘要: (1)有气泡冒出 发热 Zn+H2SO4→ZnSO4+H2↑ 置换反应 (2)检验氢气纯度 C 黑色氧化铜变为红色.有无色液体生成 后.先 (3)点燃出口D处的氢气 (说明:“后.先 为一组.该组共1分.该组内错一空即不得分.其余每空1分.共6分)
网址:http://m.1010jiajiao.com/timu3_id_117278[举报]
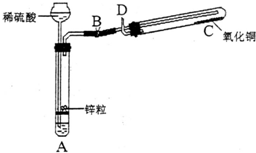 某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:
某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:(1)实验时,打开B处止水夹,在试管A中,除了液面上升以外,用眼睛还可以观察到的现象是
有气泡冒出
有气泡冒出
,过一段时间后,用手触摸试管A的外壁可以感觉到的现象是发热
发热
,试管A中发生反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
,其反应类型为置换反应
置换反应
.(2)在做氢气还原氧化铜实验之前,必须在D出口处
检验氢气的纯度
检验氢气的纯度
,然后在C
C
处点燃酒精灯加热;实验过程中,在试管C中可以观察到的现象是黑色氧化铜变为红色,有无色液体生成
黑色氧化铜变为红色,有无色液体生成
;发生反应的化学方程式为H2+CuO
Cu+H2O
| ||
H2+CuO
Cu+H2O
;实验结束时,
| ||
后
后
关闭B处止水夹,先
先
停止加热(填“先”或“后”).(3)实验过程中,该同学若想证明氢气具有可燃性,其实验操作是
点燃出口D处的氢气
点燃出口D处的氢气
.13、化学课上某校宋老师在引导学生分析了某干电池的结构后,又引导学生对有关问题进行了如下实验探究:
提出问题:电池里的电能是怎样产生的呢?
猜想与假设:你的猜想是
设计并进行实验:
(1)将一根锌片和一根铜片平行插入盛有稀硫酸的烧杯中,观察到的现象是
(2)再将上述锌片和铜片用导线连接起来,并在导线中间连接一只灵敏电流计,观察到的现象是
(3)最后把上述锌片和铜片从稀硫酸中移出并擦干,再使两者接触,观察到电流计中
(4) 用砂纸擦除铜片和锌片表面的氧化膜,用导线将铜片和锌片分别连接到电流计的正负极,然后把锌片和铜片一起插入盛有硫酸铜溶液的烧杯中可以观察到的现象有:
获得结论:通过上述实验,验证了你的猜想.
交流与反思:.通过化学反应可以将化学能转化成
查看习题详情和答案>>
提出问题:电池里的电能是怎样产生的呢?
猜想与假设:你的猜想是
化学能转化为电能
设计并进行实验:
(1)将一根锌片和一根铜片平行插入盛有稀硫酸的烧杯中,观察到的现象是
锌片表面有气泡,铜片无现象
;你对此进行的解释是锌为活泼金属能置换出酸中的氢,而铜不能
,用有关的化学方程式表示是Zn+H2SO4=ZnSO4+H2↑
;(2)再将上述锌片和铜片用导线连接起来,并在导线中间连接一只灵敏电流计,观察到的现象是
电流计指针偏转,铜片上有气泡冒出
;(3)最后把上述锌片和铜片从稀硫酸中移出并擦干,再使两者接触,观察到电流计中
没有
(有或没有)电流通过.(4) 用砂纸擦除铜片和锌片表面的氧化膜,用导线将铜片和锌片分别连接到电流计的正负极,然后把锌片和铜片一起插入盛有硫酸铜溶液的烧杯中可以观察到的现象有:
锌片溶解
,铜片上析出铜
,溶液蓝色变浅
,电流计指针偏向铜
(填铜锌).实验中发生能量变化的化学反应方程式是Zn+CuSO4=Cu+ZnSO4
.获得结论:通过上述实验,验证了你的猜想.
交流与反思:.通过化学反应可以将化学能转化成
热能
、光能
、电能
等,人们学习和研究化学最基本目的,就是通过化学反应获取人类生产和生活所需要的物质
和能量
.