网址:http://m.1010jiajiao.com/timu3_id_115267[举报]
空气是一种宝贵的自然资源。
(1)右图是测定空气中氧气体积分数的实验示意图。
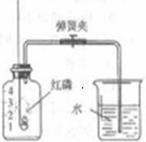 ①实验时,取下橡皮塞,点燃红磷迅速伸入集气瓶中并塞紧橡
①实验时,取下橡皮塞,点燃红磷迅速伸入集气瓶中并塞紧橡
皮塞,待反应结束装置冷却至室温后,打开弹簧夹,能观察到
的现象是__________________ ___________________________。
___________________________。
②若实验测得空气中氧气的含量偏低,可能的原因是________
(填序号)。
A.使用的红磷量不足
B.装置气密性不好
C.实验中弹簧夹没有夹紧
(2)目前人类使用的主要能源是三大化石燃料:_________、___________、_________。
①燃烧化石燃料会使空气中二氧化碳含量增加,造成的环境问题是___________,不仅如此,还会造成资源的浪费。因此,我们既要节约使用化石燃料,又要开发利用新能源,请你写出一种新能源 ________________。
________________。
②我国已经开发和推广使用乙醇汽油,其中含乙醇10%,使用这种乙醇汽油的好处是
_________________________(写出一点)。
查看习题详情和答案>>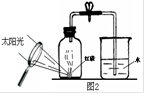
(1)右图是用白磷测定空气中氧气含量的一种方法。
该实验说明氧气约占空气总体积的 ,还说明氮气具有
的性质(一条即可)。图中放大镜为白磷燃烧提供的条件是 。请写出实验室用高锰酸钾制取氧气的化学方程式 。
(2)臭氧层空洞、酸雨和温室效应是当今世界三大环境问题。形成酸雨的主要原因是空气受硫和氮的氧化物的污染。请举一例,说明酸雨的危害 。
下列反应都与CO2有关,试分析判断,会加剧“温室效应”的主要化学反应有 (填序号)。
A.煤燃烧 B.石油产品燃烧 C.植物的光合作用
(3)煤、石油、 属于化石燃料。要节约和有效利用现有的能源,我们还应该开发新能源,如: (一种即可)、核能、地热能等。
(9分)空气是一种宝贵的自然资源,请结合相关知识回答下列问题: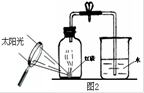
(1)右图是用白磷测定空气中氧气含量的一种方法。
该实验说明氧气约占空气总体积的 ,还说明氮气具有
的性质(一条即可)。图中放大镜为白磷燃烧提供的条件是 。请写出实验室用高锰酸钾制取氧气的化学方程式 。
(2)臭氧层空洞、酸雨和温室效应是当今世界三大环境问题。形成酸雨的主要原因是空气受硫和氮的氧化物的污染。请举一例,说明酸雨的危害 。
下列反应都与CO2有关,试分析判断,会加剧“温室效应”的主要化学反应有 (填序号)。
A.煤燃烧 B.石油产品燃烧 C.植物的光合作用
(3)煤、石油、 属于化石燃料。要节约和有效利用现有的能源,我们还应该开发新能源,如: (一种即可)、核能、地热能等。
(9分)空气是一种宝贵的自然资源,请结合相关知识回答下列问题:

(1)右图是用白磷测定空气中氧气含量的一种方法。
该实验说明氧气约占空气总体积的 ,还说明氮气具有
的性质(一条即可)。图中放大镜为白磷燃烧提供的条件是 。请写出实验室用高锰酸钾制取氧气的化学方程式 。
(2)臭氧层空洞、酸雨和温室效应是当今世界三大环境问题。形成酸雨的主要原因是空气受硫和氮的氧化物的污染。请举一例,说明酸雨的危害 。
下列反应都与CO2有关,试分析判断,会加剧“温室效应”的主要化学反应有 (填序号)。
A.煤燃烧 B.石油产品燃烧 C.植物的光合作用
(3)煤、石油、 属于化石燃料。要节约和有效利用现有的能源,我们还应该开发新能源,如: (一种即可)、核能、地热能等。
查看习题详情和答案>>
海洋是个巨大的宝库,为人类提供了宝贵的自然资源。
(1)食用海鱼摄取的主要营养素是 。
(2)右图为海水淡化装置,利用的能源是 ,获得的蒸馏水属于 (填字母序号)。
A.单质 B.化合物 C.混合物
(3)利用海水可制取许多化工产品。用海水制食盐,常通过海水晒盐得到粗盐,粗盐中含有少量的CaCl2、Na2SO4等杂质。 除去上述杂质,先加过量BaCl2溶液除去 ,再加过量 溶液除去CaCl2和过量的BaCl2,生成的沉淀经 除去,最后加入 调节pH,蒸发,结晶,制得精盐。
(4)用氯化钠和碳酸氢铵NH4HCO3可制备碳酸氢钠和氯化铵NH4Cl,该反应化学方程式可表示为:NaCl+ NH4HCO3=NaHCO3+NH4Cl。
20℃时,按上述化学方程式中反应物的质量比,向100 g水中加入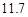 g NaCl和
g NaCl和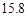 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| 溶解度/g |  | 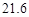 |  | 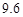 |
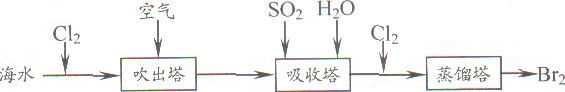
①写出氯气置换出溴单质的化学方程式: ;该反应在pH=3的酸性条件下进行,可用 测定反应液的酸碱度。
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O==H2SO4+2HBr)。根据流程图分析,通入SO2的目的是 。 查看习题详情和答案>>