网址:http://m.1010jiajiao.com/timu3_id_102935[举报]
(1)将混合气体首先通过① ,目的是② ;
(2)将由(1)得到气体,继续通过① ,实验中观察到的现象是②
(3)将由(2)得到气体,依次通过① 和② ,若③ 变成
④ ,证明原混合气体中有氢气存在;若⑤ 变⑥ ,证明原混合气体中有一氧化碳存在. 查看习题详情和答案>>
(1)将混合气体首先通过①
(2)将由(1)得到气体,继续通过①
(3)将由(2)得到气体,依次通过①
④
水煤气是一种工业上常用的气体燃料,一般用焦炭和水蒸气在高温下反应制得,含有少量的CO2和水蒸气杂质.某化学兴趣小组对水煤气的主要成分进行研究.
【查阅资料】
(1)白色的无水硫酸铜粉末遇水变成蓝色;
(2)Na2CO3与少量盐酸反应生成NaHCO3和NaCl,与过量盐酸反应时生成NaCl,H2O,CO2
【实验假设】
①可燃气只是CO
②可燃气体只是H2
③可燃气体是CO,H2的混合气.
【实验过程】
实验小组按以下流程进行实验(水煤气中CO2,H2O已被充分吸收);
实验中,发现黑色氧化铜变红,且 ,证明水煤气含有H2;还观察到澄清石灰水变浑浊,证明水煤气含有另一可燃气体为
【实验反思】
根据实验结论,甲同学认为实验应保证安全,防止中毒,对尾气的处理方法是 。
【实验拓展】
(1)实验后,乙同学认为欲检验所用NaOH是否完全消耗,可向溶液中滴入几滴稀盐酸,若没有气体产生,则溶液中还有NaOH剩余,但丙同学认为乙同学的设计是错误的,理由是 。
(2)丁同学通过本次实验,结合查阅的资料发现,不用任何其它试剂,只用试管和胶头滴管就可以鉴别稀盐酸和碳酸钠两种无色溶液.正确的鉴别方案及结论是 .
水煤气是一种工业上常用的气体燃料,一般用焦炭和水蒸气在高温下反应制得,含有少量的CO2和水蒸气杂质.某化学兴趣小组对水煤气的主要成分进行研究.
【查阅资料】
(1)白色的无水硫酸铜粉末遇水变成蓝色;
(2)Na2CO3与少量盐酸反应生成NaHCO3和NaCl,与过量盐酸反应时生成NaCl,H2O,CO2
【实验假设】
①可燃气只是CO
②可燃气体只是H2
③可燃气体是CO,H2的混合气.
【实验过程】
实验小组按以下流程进行实验(水煤气中CO2,H2O已被充分吸收);

实验中,发现黑色氧化铜变红,且______,证明水煤气含有H2;还观察到澄清石灰水变浑浊,证明水煤气含有另一可燃气体为______
【实验反思】
根据实验结论,甲同学认为实验应保证安全,防止中毒,对尾气的处理方法是______
【实验拓展】
(1)实验后,乙同学认为欲检验所用NaOH是否完全消耗,可向溶液中滴入几滴稀盐酸,若没有气体产生,则溶液中还有NaOH剩余,但丙同学认为乙同学的设计是错误的,理由是______
(2)丁同学通过本次实验,结合查阅的资料发现,不用任何其它试剂,只用试管和胶头滴管就可以鉴别稀盐酸和碳酸钠两种无色溶液.正确的鉴别方案及结论是______.
查看习题详情和答案>>
水煤气是一种工业上常用的气体燃料,一般用焦炭和水蒸气在高温下反应制得,含有少量的CO2和水蒸气杂质.某化学兴趣小组对水煤气的主要成分进行研究.
【查阅资料】
(1)白色的无水硫酸铜粉末遇水变成蓝色;
(2)Na2CO3与少量盐酸反应生成NaHCO3和NaCl,与过量盐酸反应时生成NaCl,H2O,CO2
【实验假设】
①可燃气只是CO
②可燃气体只是H2
③可燃气体是CO,H2的混合气.
【实验过程】
实验小组按以下流程进行实验(水煤气中CO2,H2O已被充分吸收);
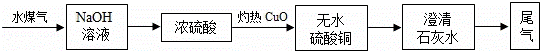
实验中,发现黑色氧化铜变红,且 ,证明水煤气含有H2;还观察到澄清石灰水变浑浊,证明水煤气含有另一可燃气体为
【实验反思】
根据实验结论,甲同学认为实验应保证安全,防止中毒,对尾气的处理方法是 【实验拓展】
(1)实验后,乙同学认为欲检验所用NaOH是否完全消耗,可向溶液中滴入几滴稀盐酸,若没有气体产生,则溶液中还有NaOH剩余,但丙同学认为乙同学的设计是错误的,理由是
(2)丁同学通过本次实验,结合查阅的资料发现,不用任何其它试剂,只用试管和胶头滴管就可以鉴别稀盐酸和碳酸钠两种无色溶液.正确的鉴别方案及结论是
;
.
查看习题详情和答案>>