摘要:16.2g黄铜粉末与309.4g稀硫酸恰好完全反应.放出0.4g气体.求:反应后所得溶液中溶质的质量分数.
网址:http://m.1010jiajiao.com/timu3_id_100991[举报]
已知木炭粉与某红棕色粉末在高温下反应生成二氧化碳和铁.某同学设计了一个实验,证明红棕色粉末中含有氧元素,并测定其中氧元素的质量分数,装置如图所示.
(1)实验前,首先要进行的操作是
(2)实验中,盛放澄清石灰水的大试管中出现的现象是
(3)实验中通入纯净而干燥的氮气,其目的是
(4)尾气中可能含有的一种有毒气体是
(5)如果3.2g该红棕色粉末与碳充分反应,测得澄清石灰水增重1.32g,则该红棕色粉末中氧元素的质量分数为
查看习题详情和答案>>

(1)实验前,首先要进行的操作是
检查装置的气密性,通氮气赶走装置中残余的空气
检查装置的气密性,通氮气赶走装置中残余的空气
;(2)实验中,盛放澄清石灰水的大试管中出现的现象是
澄清石灰水变浑浊
澄清石灰水变浑浊
;(3)实验中通入纯净而干燥的氮气,其目的是
防止空气中二氧化碳及空气中氧气与炭粉反应,氮气中的水分也会影响对生成二氧化碳质量的测定
防止空气中二氧化碳及空气中氧气与炭粉反应,氮气中的水分也会影响对生成二氧化碳质量的测定
;(4)尾气中可能含有的一种有毒气体是
一氧化碳
一氧化碳
;(5)如果3.2g该红棕色粉末与碳充分反应,测得澄清石灰水增重1.32g,则该红棕色粉末中氧元素的质量分数为
30%
30%
写出计算过程如下:测得石灰水增重1.32g,即充分反应后生成二氧化碳质量为1.32g;
生成的1.32g二氧化碳中氧元素质量=1.32g×
×100%=0.96g
红棕色粉末中氧元素的质量分数=
×100%=30%
生成的1.32g二氧化碳中氧元素质量=1.32g×
| 16×2 |
| 44 |
红棕色粉末中氧元素的质量分数=
| 0.96g |
| 3.2g |
测得石灰水增重1.32g,即充分反应后生成二氧化碳质量为1.32g;
生成的1.32g二氧化碳中氧元素质量=1.32g×
×100%=0.96g
红棕色粉末中氧元素的质量分数=
×100%=30%
.生成的1.32g二氧化碳中氧元素质量=1.32g×
| 16×2 |
| 44 |
红棕色粉末中氧元素的质量分数=
| 0.96g |
| 3.2g |
(2013?栖霞区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(1)不法分子常用黄铜制成金光闪闪的“假元宝”蒙骗人们.下列鉴别方法中错误的是
A. 看颜色 B. 灼烧
C. 加硝酸银溶液 D. 加盐酸
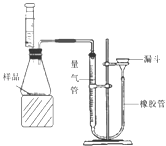
(2)为了测定某铜锌合金的组成,校化学课外活动小组利用该合金粉末与稀硫酸反应,设计了如图所示的实验装置进行实验.
①检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差
②正确读取量气管内液面的初始、最终读数前都需进行的操作是
③该小组进行了三次实验,所得相关的实验数据处理如下:
a、列式计算2g合金中,锌的质量:
b、分析上表数据,第
查看习题详情和答案>>
(1)不法分子常用黄铜制成金光闪闪的“假元宝”蒙骗人们.下列鉴别方法中错误的是
A
A
A. 看颜色 B. 灼烧

C. 加硝酸银溶液 D. 加盐酸
(2)为了测定某铜锌合金的组成,校化学课外活动小组利用该合金粉末与稀硫酸反应,设计了如图所示的实验装置进行实验.
①检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差
不变
不变
,说明气密性良好.②正确读取量气管内液面的初始、最终读数前都需进行的操作是
调节两边液面相平
调节两边液面相平
.③该小组进行了三次实验,所得相关的实验数据处理如下:
| 合金的质量/g | 稀硫酸的体积/mL | 生成氢气的质量/g | |
| 第1次 | 2 | 15 | 0.04 |
| 第2次 | 2 | 20 | 0.04 |
| 第3次 | 4 | 15 | 0.04 |
1.3g
1.3g
b、分析上表数据,第
1
1
次实验,合金中的锌与稀硫酸恰好完全反应.稀硫酸的溶质质量分数为12.1%
12.1%
(结果保留到0.1%).(实验温度下,ρH2SO4=1.08g/cm3)(2012?景德镇二模)黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品.为测定黄铜样品的组成(不考虑黄铜中的其他杂质),某同学将80g同种稀盐酸分四次加入到10g黄铜样品粉末中,待每次充分反应后,测定生成氢气的质量,实验数据见下表:
(1)从上表数据分析,是否能省去第四次加入的稀盐酸?(填:能或不能)
(2)10g合金粉末与稀盐酸反应共生成氢气
(3)求该合金中铜的质量分数;
(4)该黄铜与稀盐酸恰好完全反应时所得溶液质量为多少g?
查看习题详情和答案>>
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 连续加入盐酸的质量/g | 20 | 20 | 20 | 20 |
| 生成氢气的质量/g | 0.08 | 0.08 | 0.04 | ? |
能
能
;(2)10g合金粉末与稀盐酸反应共生成氢气
0.2
0.2
g;(3)求该合金中铜的质量分数;
(4)该黄铜与稀盐酸恰好完全反应时所得溶液质量为多少g?
(2008?茂名)李红在查阅资料是发现CO2+C
2CO,于是她对过量木炭和氧化铁在高温条件下,最终产生的气体是什么产生兴趣,决定进行探究.请回答有关问题:
[提出问题]过量木炭和氧化铁反应产生的气体是什么呢?
[猜想和假设]猜想①:可能是CO2;猜想②:可能是CO;猜想③:
[实验方案与现象]将产生的气体通入澄清石灰水,澄清石灰水变浑浊.
[结论]猜想①正确.
[反思与评价]小雨不同意李红的观点,理由是
①称取3.2g的氧化铁与2g木炭均匀混合,放进18.48g的试管中,加热.
②完全反应后,冷却至室温,称得试管和固体的总质量为22.24g
③往试管中加入足量稀盐酸,然后过滤,洗涤,烘干,称量,得到1.52g黑色粉末.
[数据处理]:参加反应的碳元素的质量为
[得到结论]:根据数据处理结果,得到原猜想③成立,理由是
查看习题详情和答案>>
| ||
[提出问题]过量木炭和氧化铁反应产生的气体是什么呢?
[猜想和假设]猜想①:可能是CO2;猜想②:可能是CO;猜想③:
可能是CO2和CO的混合气体
可能是CO2和CO的混合气体
.[实验方案与现象]将产生的气体通入澄清石灰水,澄清石灰水变浑浊.
[结论]猜想①正确.
[反思与评价]小雨不同意李红的观点,理由是
猜想1和猜想3都能使澄清石灰水变浑浊
猜想1和猜想3都能使澄清石灰水变浑浊
.于是小雨进行如下的实验以验证猜想:①称取3.2g的氧化铁与2g木炭均匀混合,放进18.48g的试管中,加热.
②完全反应后,冷却至室温,称得试管和固体的总质量为22.24g
③往试管中加入足量稀盐酸,然后过滤,洗涤,烘干,称量,得到1.52g黑色粉末.
[数据处理]:参加反应的碳元素的质量为
0.48g
0.48g
,氧元素质量为0.96g
0.96g
.[得到结论]:根据数据处理结果,得到原猜想③成立,理由是
气体中的C:O原子个数比为(0.48/12):(0.96/16)=1:1.5,若是纯CO,应该是1:1.纯CO2应该是
1:2、现在为1:1.5,说明应该是混合气体CO和CO2 .
1:2、现在为1:1.5,说明应该是混合气体CO和CO2 .
气体中的C:O原子个数比为(0.48/12):(0.96/16)=1:1.5,若是纯CO,应该是1:1.纯CO2应该是
1:2、现在为1:1.5,说明应该是混合气体CO和CO2 .
.1:2、现在为1:1.5,说明应该是混合气体CO和CO2 .
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(1)不法分子常用黄铜制成金光闪闪的“假元宝”蒙骗人们.下列鉴别方法中错误的是 。
| A.看颜色 | B.灼烧 | C.加硝酸银溶液 | D.加盐酸 |
①检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差 ,说明气密性良好。
②正确读取量气管内液面的初始、最终读数前都需进行的操作是 。③该小组进行了三次实验,所得相关的实验数据处理如下:
| | 合金的质量/g | 稀硫酸的体积/mL | 生成氢气的质量/g |
| 第1次 | 2 | 15 | 0.04 |
| 第2次 | 2 | 20 | 0.04 |
| 第3次 | 4 | 15 | 0.04 |
b、分析上表数据,第 次实验,合金中的锌与稀硫酸恰好完全反应,稀硫酸的溶质质量分数为 (结果保留到0.1%)。(实验温度下,ρ(H2SO4)=1.08g/cm3)
 查看习题详情和答案>>
查看习题详情和答案>>