摘要:下列措施能同时减小气体在水里的溶解度的是------( ) A.加压.降温 B.加压.升温 C.减压.降温 D.减压.升温
网址:http://m.1010jiajiao.com/timu3_id_100334[举报]
 2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:
2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:(1)取回水样,静置后过滤,在实验室里,过滤需要用到的玻璃仪器有
烧杯
烧杯
、漏斗和玻璃棒.(2)若要测定某湖水质的酸碱性强弱,最适宜的是(填字母)
B
B
.A.酚酞试液 B.PH试纸 C.石蕊试液
(3)下列做法会造成水体污染的是 (填字母)
AB
AB
.A.随意弃置废旧电池 B.含二氧化硫的工业废气任意排放
C.工业废水处理达标后再排放 D.严格监管化肥和农药的使用
(4)节约用水从我做起请任举一生活中节约用水的措施:
用洗菜水冲刷厕所
用洗菜水冲刷厕所
(5)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是
蒸馏
蒸馏
.生活中降低水硬度最常用的方法是煮沸
煮沸
.(6)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式:
2H20
2H2↑+O2↑
| ||
| 光照 |
2H20
2H2↑+O2↑
.
| ||
| 光照 |
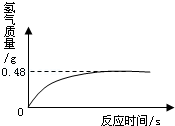
(7)过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示.试计算该过氧化氢溶液中溶质的质量分数.
 2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:
2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:
(1)取回水样,静置后过滤,在实验室里,过滤需要用到的玻璃仪器有______、漏斗和玻璃棒.
(2)若要测定某湖水质的酸碱性强弱,最适宜的是(填字母)______.
A.酚酞试液 B.PH试纸 C.石蕊试液
(3)下列做法会造成水体污染的是 (填字母)______.
A.随意弃置废旧电池 B.含二氧化硫的工业废气任意排放
C.工业废水处理达标后再排放 D.严格监管化肥和农药的使用
(4)节约用水从我做起请任举一生活中节约用水的措施:______
(5)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是______.生活中降低水硬度最常用的方法是______.
(6)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式:______.
(7)过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示.试计算该过氧化氢溶液中溶质的质量分数.
查看习题详情和答案>>
2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:
(1)取回水样,静置后过滤,在实验室里,过滤需要用到的玻璃仪器有______、漏斗和玻璃棒.
(2)若要测定某湖水质的酸碱性强弱,最适宜的是(填字母)______.
A.酚酞试液 B.PH试纸 C.石蕊试液
(3)下列做法会造成水体污染的是 (填字母)______.
A.随意弃置废旧电池 B.含二氧化硫的工业废气任意排放
C.工业废水处理达标后再排放 D.严格监管化肥和农药的使用
(4)节约用水从我做起请任举一生活中节约用水的措施:______
(5)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是______.生活中降低水硬度最常用的方法是______.
(6)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式:______.
(7)过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示.试计算该过氧化氢溶液中溶质的质量分数.
查看习题详情和答案>>
(1)取回水样,静置后过滤,在实验室里,过滤需要用到的玻璃仪器有______、漏斗和玻璃棒.
(2)若要测定某湖水质的酸碱性强弱,最适宜的是(填字母)______.
A.酚酞试液 B.PH试纸 C.石蕊试液
(3)下列做法会造成水体污染的是 (填字母)______.
A.随意弃置废旧电池 B.含二氧化硫的工业废气任意排放
C.工业废水处理达标后再排放 D.严格监管化肥和农药的使用
(4)节约用水从我做起请任举一生活中节约用水的措施:______
(5)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是______.生活中降低水硬度最常用的方法是______.
(6)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式:______.
(7)过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示.试计算该过氧化氢溶液中溶质的质量分数.

2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:
(1)取回水样,静置后过滤,在实验室里,过滤需要用到的玻璃仪器有 、漏斗和玻璃棒。
(2)若要测定某湖水质的酸碱性强弱,最适宜的是(填字母) 。
A. 酚酞试液 B. PH试纸 C.石蕊试液
(3)下列做法会造成水体污染的是 (填字母) .
A.随意弃置废旧电池 B.含二氧化硫的工业废气任意排放
C.工业废水处理达标后再排放 D.严格监管化肥和农药的使用
(4)节约用水从我做起请任举一生活中节约用水的措施:
(5)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是 。生活中降低水硬度最常用的方法是 。
(6)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式: 。
(7)过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小。小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数。他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示。
试计算该过氧化氢溶液中溶质的质量分数。
(2012?南宁)某研究性学习活动小组,从下列装置中选用部分装置组装后在实验室里制取氧气,并通过排水量来测定所收集到氧气的体积.
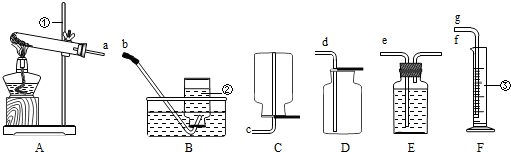
(1)写出图中有标号的仪器的名称:①
(2)甲同学用一定质量的高锰酸钾制取氧气,反应的化学方程式为
(3)实验过程中,甲同学观察到E装置中的水变为紫红色,这是因为
(4)实验结束,乙同学意外发现收集到的氧气体积大于理论值,为此继续进行以下实验探究:
【提出问题】出现“收集到的氧气体积大于理论值”的原因是什么?
【作出猜想】猜想Ⅰ:可能是反应生成的二氧化锰分解放出氧气;
猜想Ⅱ:可能是反应生成的锰酸钾分解放出氧气;
猜想Ⅲ:
做出以上猜想的理由是
【实验验证】(每种方法只限用一次)
实验一:取一定量的二氧化锰于试管中,加热一段时间,冷却后测得二氧化锰的质量不变.证明猜想
实验二:取少量锰酸钾于试管中加,热一段时间,
【反思拓展】实验结束后,经过讨论、交流,丙同学用下列仪器和药品设计了一个实验方案测定空气中氧气的含量.
①带瓶塞的1000ml烧瓶 ②电子天平(称量精确度为0.01g) ③酒精灯 ④某种金属粉末(实验过程中需要用到的其它实验用品已省略)
他的实验步骤是:
查看习题详情和答案>>

(1)写出图中有标号的仪器的名称:①
铁架台
铁架台
②集气瓶
集气瓶
③量筒
量筒
(2)甲同学用一定质量的高锰酸钾制取氧气,反应的化学方程式为
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,整套实验装置接口的正确连接顺序为a→
| ||
f
f
→e
e
→g
g
.(3)实验过程中,甲同学观察到E装置中的水变为紫红色,这是因为
试管口没有放棉花团,高锰酸钾
试管口没有放棉花团,高锰酸钾
进入E装置并溶于水中的缘故.为了防止试验过程中出现上述现象,相应的改进措施是在试管口放棉花团
在试管口放棉花团
.(4)实验结束,乙同学意外发现收集到的氧气体积大于理论值,为此继续进行以下实验探究:
【提出问题】出现“收集到的氧气体积大于理论值”的原因是什么?
【作出猜想】猜想Ⅰ:可能是反应生成的二氧化锰分解放出氧气;
猜想Ⅱ:可能是反应生成的锰酸钾分解放出氧气;
猜想Ⅲ:
可能是锰酸钾和二氧化锰共同放出氧气
可能是锰酸钾和二氧化锰共同放出氧气
.做出以上猜想的理由是
锰酸钾和二氧化锰都含有氧元素
锰酸钾和二氧化锰都含有氧元素
.【实验验证】(每种方法只限用一次)
实验一:取一定量的二氧化锰于试管中,加热一段时间,冷却后测得二氧化锰的质量不变.证明猜想
Ⅰ
Ⅰ
错误.实验二:取少量锰酸钾于试管中加,热一段时间,
冷却后测得锰酸钾的质量减少
冷却后测得锰酸钾的质量减少
.证明猜想Ⅱ正确.【反思拓展】实验结束后,经过讨论、交流,丙同学用下列仪器和药品设计了一个实验方案测定空气中氧气的含量.
①带瓶塞的1000ml烧瓶 ②电子天平(称量精确度为0.01g) ③酒精灯 ④某种金属粉末(实验过程中需要用到的其它实验用品已省略)
他的实验步骤是:
先用电子天平称出金属粉末的质量;再把金属粉末在带瓶塞的1000ml烧瓶灼烧,至氧气充分反应;再称量反应后金属粉末的质量;最后通过密度公式求氧气的体积;
先用电子天平称出金属粉末的质量;再把金属粉末在带瓶塞的1000ml烧瓶灼烧,至氧气充分反应;再称量反应后金属粉末的质量;最后通过密度公式求氧气的体积;
,通过计算得出空气中氧气的含量.