揭阳二中2008~2009学年度第二学期阶段考试
化学科试题
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Ca 40 Cu 64 Ag 108
第一部分选择题(共63分)
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
1、焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是( )
A.非金属单质燃烧时火焰均为无色 B.所有金属及其化合物灼烧时火焰均有颜色
C.焰色反应均应透过蓝色钴玻璃观察 D.NaC1与Na2CO3灼烧时火焰颜色相同
2、 新华社
A.111号元素是第6周期、第ⅠA族的金属元素 B.111号元素属于过渡元素
C.111号元素为非金属元素 D.111号元素质量数为111
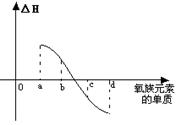
3、化学反应N2+3H2 = 2NH3的能量变化如下图所示,该反应的热化学方程式是( )
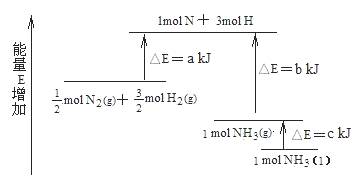
A.N2(g)+3H2(g)=2NH3(g) △H=2(b―a)kJ?mol-1
B. N2(g)+3H2(g)=2NH3(l) △H=2(a―b―c)kJ?mol-1
C. N2(g)+H2(g)=NH3(l) △H=(b+c―a)kJ?mol-1
D. N2(g)+H2(g)=NH3(g) △H=(a+b)kJ?mol-1
4、设NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
A.常温常压下,1mol氦气含有2NA个原子
B.标准状况下,0.5NA个CCl4所占的体积约为
C.
D.用惰性电极电解
5、下列实验设计能够成功的是( )

A、检验亚硫酸钠试样是否变质:
 |
B、除去乙酸乙酯中混有的乙酸:
 |
C、证明酸性条件下H2O2氧化性比I2强:
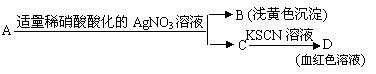 |
D、鉴定盐A的成分是FeBr2:
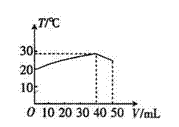 6、向盛有50mL
1.00mol?L-1HC1溶液的绝热容器中加入NaOH溶液,
6、向盛有50mL
1.00mol?L-1HC1溶液的绝热容器中加入NaOH溶液,
NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系
如图所示,下列叙述中不正确的是( )
A.该实验表明化学能可以转化为热能
B.NaOH溶液的浓度大于1.00mol?L-1
C.V=50mL时,混合液的pH>7
D.该实验表明有水生成的反应都是放热反应
7.已知
A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) D.c(K+)>c(NO3―)>c(Ag+)= c(Cl-) + c(I-)
8、现有常温下的四份溶液:①0.01mol?L-1CH3COOH;②0.01mol?L-1HC1;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是( )
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若pH=7,则消耗溶液的体积:②=③
C.将四份溶液稀释相同倍数后,溶液的pH:③>④;②>①
D.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性
9.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是( )
①有固体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的积不变 ⑤c(H+)一定增大
A.① B.①③ C.①②④ D.①⑤
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
10、X+、Y+、M2+、N2-均为含若干电子的短周期元素的简单离子,离子半径大小关系:N2->Y+、Y+>X+、Y+>M2+、M2+>X+。下列比较中正确的是( )
A.原子半径:N可能比Y大,也可能比Y小 B.原子序数:N>M>X>Y
C. M2+、N2-核外电子数:可能相等,也可能不等 D.碱性:M(OH)2 >YOH
11、铜的冶炼大致可分为:①.富集,将硫化物矿进行浮选;
②.焙烧,主要反应为:2CuFeS2+4O2==Cu2S+3SO2+2 FeO(炉渣);
③.制粗铜,在1200℃发生的主要反应为:
2Cu2S+3O2 ==2Cu2O+2SO2 ;2Cu2O+ Cu2S==6 Cu+SO2↑;
④.电解精炼铜。
下列说法正确的是( )
A.上述灼烧过程的尾气均可直接排空
B.上述过程中,由6mol CuFeS2制取6molCu时共消耗12 molO2
C.在反应2Cu2O+ Cu2S == 6 Cu+SO2↑中,只有Cu2O作氧化剂
D.电解精炼铜时,粗铜应与外接电源的正极相连接
12、下列离子方程式书写正确的是( )
A.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.用石墨作电极电解MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.向Ca(ClO)2溶液中通入适量SO2 : Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.向氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
13、室温下,某溶液中由水电离出的H+和OH-物质的量浓度乘积为1×10-28,该溶液中一定不能大量共存的是( )
A.Cl-、AlO2-、K+、Na+ B.Fe2+、NO3-、Ba2+、Cl-
C.Fe3+、SO42-、MnO4-、Na+ D.Na+、K+、CO32-、SO42-
14、下列各溶液中,叙述正确的是( )
A.0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.
C.将0.1mol/L 醋酸溶液加大量水稀释后,溶液的pH增大
D.Na2CO3溶液中:c(Na+)=
15、下列实验操作完全正确的是( )
A.配制100 mL 0.1 mol?L-1的NaCl溶液时,先量取10 mL 1 mol?L-1的NaCl溶液倒入容量瓶中,再加水稀释至刻度线
B.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
C.制备乙酸乙酯时,将乙醇和乙酸依次加入加入到浓硫酸中
D.乙醇与金属钠的反应,在盛有少量乙醇溶液的试管中,加入一小块新切的、用滤纸擦干表面煤油的金属钠
16、下列叙述不正确的是( )
A.金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料 B.水晶和玛瑙的主要成分都是SiO2
C.含硅的钢具有良好的导磁性 D.利于环保、节能的太阳能电池可用硅材料制作
17、在一定条件下密闭容器中的反应:
x
y
A
再加入A
B的转化率
B
再加入C
A的体积分数
C
缩小体积
A的转化率
D
升高温度
混合气体的平均摩尔质量
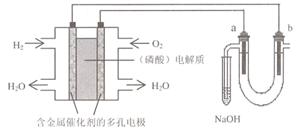 18、用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是( )
18、用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是( )
A.电池工作时,正极反应式为:
O2 +2 H2O + 4e―= 4OH?
B.电解时,a 电极周围首先放电的是Br-
而不是Cl-,说明当其它条件相同时前者的
还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗
第二部分非选择题(共87分)
三、(本题包括2小题,共27分)
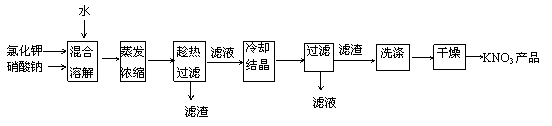 19(11分)实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下:
19(11分)实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下:

 (?)CH3CHCH3 ――――――――→CH3CH==CH2 +
(CH3)2CHOC2H5+HBr
(?)CH3CHCH3 ――――――――→CH3CH==CH2 +
(CH3)2CHOC2H5+HBr (?)CH3CH2CHCH3――――――→ CH3CH==CHCH3+ CH3CH2CH==CH2+HX
(?)CH3CH2CHCH3――――――→ CH3CH==CHCH3+ CH3CH2CH==CH2+HX
 (2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)
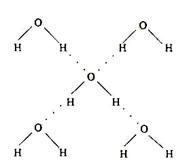
(2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)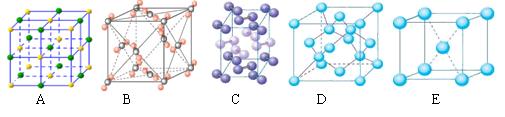 (3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol; 揭阳第二中学2008―2009学年度第二学期第一次阶段考试
揭阳第二中学2008―2009学年度第二学期第一次阶段考试

 (2分)
(2分)




