2009年成都市高中阶段教育学校统一招生考试
化学
(满分90分,考试时间60分钟)
第Ⅰ卷(选择题共36分)
一、选择题(本题包括12个小题,每小题3分,共36分。每小题只有一选项符合题意)
1.最近流行的甲型H1N1流感,感染早期用达菲治疗有效。从达菲分子的结构图中,不能推断出达菲的( )
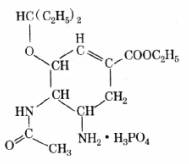
A.组成元素 B.颜色、气味
C.化学式 D.相对分子质量
2.有研究认为,“达菲”的治疗机理是药物与病毒的一种主要表面酶结合,使其不能离开已被感染的宿主细胞。这里的“酶”应是一种 ( )
A.维生素 B.糖 C.蛋白质 D.油脂
3.判断“达菲”的治疗机理中是否发生了化学变化,其依据是 ( )
A.病毒的大小是否改变 B.病毒的形状是否变化
C.病毒是否离开宿主细胞 D.是否有新物质生成
4.向一小烧杯自来水中滴加红墨水,红墨水会扩散于整杯水中。该现象说明( )
A.分子用肉眼可看见 B.分子在不断运动
C.分子都有颜色 D.分子运动速率很慢
5.某课外小组取上述“红色”水,加入适量纳米二氧化钛,进行“污水变纯净水”的趣味实验。纳米二氧化钛是一种新型材料,在可见光下能促使有色物质降解为水和CO2。据此推测,纳米二氧化钛在污水处理中可作 ( )
A.吸附剂 B.絮凝剂 C.消毒剂 D.催化剂
6.据统计,成都市因自来水管网老化引起的爆管事故,一年就会损失自来水300多万立方米。现在常用PVC(聚氯乙烯)等塑料管替代以前使用的镀锌钢管。PVC管的主要优点是 ( )
A.耐腐蚀,不生锈 B.具有一般金属的硬度
C.不易燃烧,可回收 D.不易造成“白色污染”
7.下表为元素周期表的一部分,A~E代表五种不同元素。下列说法不正确的是 ( )
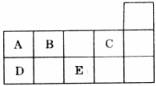
A.原子序数:C>B
B.核内质子数:A=E
C.B、C同周期
D.A、D同族
8.在大烧杯中倒入一定量水,加入适量NH4NO3,搅拌,水的温度会急剧降低。说明NH4NO3溶于水时 ( )
A.吸收热量 B.放出热量
C.既不吸热也不放热 D.无法判断
9.将少量大豆油倒入一个小铁盒中点燃,用坩埚钳把小铁盒放在冰冷的水面上,可观察到火焰立即熄灭。该实验证明,达到灭火目的的方法之一是 ( )
A.清除可燃物 B.隔绝空气
C.降温至着火点以下 D.降低着火点
10.使用图装置进行验证质量守恒定律的实验。下列反应中应选择 ( )
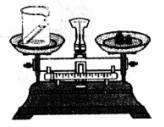
A.6HCl+2Al(OH)3==2AlCl3+6H2 O
B.CO2+H2O==H2CO3
C.NH4Cl+NaOH―NaCl+NH3↑+H2O
D.4P+5O2 2P2O5
2P2O5
11.CO2、CH4和氮氧化合物都是形成温室效应的气体。下列减缓全球气候变暖的对策中,不恰当的是 ( )
A.在某些工业生产过程中,将欲排放的CO2用化学溶剂吸收
B.禁止制备和使用CH4、N2O等温室气体
C.开发无污染的太阳能、风能、地热能等
D.变革能源消耗模式
12.下表是某同学归纳整理的复习资料。其中错误的是 ( )
物质名称
相同点
不同点
A
金刚石与石墨
常温下化学性质不活泼
原子排列方式不同,用途不同
B
不锈钢和焊锡
都是合金
光泽不同,主要成分和性能不同
C
棉纤维和羊毛纤维
都属于天然纤维
燃烧现象不同
D
纯碱和熟石灰
都是碱
熟石灰能用于中和酸性土壤,纯碱不能
第Ⅱ卷(非选择题 共54分)
二、(本题包括2个小题,共12分)
13.(6分)下表中有六种人体必需的元素。
元索名称
钙 钠 钾 铁
元素名称
碘 氟
(1)表中元素主要以__________的形式存在于人体中(填“酸”“碱”或“无机盐”)。
(2)若将表中元素进行简单分类,则碘、氟属于__________元素(填“金属”“非金属”或“稀有气体”);其中碘的元素符号是__________。
(3)钙在人体中主要以羟基磷酸钙[Ca10(PO4)6(OH)2]的形式存在。其中P的化合价为__________。
(4)人体缺铁会引起__________;为保证铁的摄入量,可选择的食物有__________ (填一种食物名称)。
14.(6分)地震发生的成因很复杂。据部分研究,孕震过程中比较活跃的物质有CO2、氢等。
Ⅰ.地震过程中,在地壳的岩层中碳酸盐受热发生如下反应:
CaCO3==CaO+CO2↑;MgCa(CO3)2==MgO+CaO+2CO2↑
(1)上述两个反应的特点是:反应类型均为____________________;反应产物均是__________ (填“单质” “化合物”或“有机物”)。
(2)正确书写化学方程式:上述两个反应式还应补充__________。
(3)当地应力(压力)增大时,CO2在地下水中溶解度增大,同时使得水的pH发生变化。
①在图中绘出CO2在地下水中随压力由P1变化到P2时的溶解度曲线示意图;
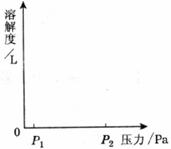
②若地应力增大时,地下水的pH减小,则地下水的酸性__________ (填“增大”“减小”或“不变”)。
Ⅱ.氢在目前的地震预测中被公认为是一种灵敏元素。
一般认为,地壳中水蒸气和氧化亚铁(FeO)作用会产生氢气和氧化铁(Fe2O3)。该反应的化学方程式为__________。
三、(本题只有1个小题,共10分)
15.(10分)自然界中,铜多存在于矿石中。如:
矿石名称
辉铜矿
孔雀石
黄铜矿
主要成分
Cu2S
CuCO3?Cu(OH)2
CuFeS2
(1)辉铜矿中,铜的质量分数应____________80%(填“>”“ <”或“=”)。
(2)铜在潮湿的空气中易生成铜绿[CuCO3?Cu (OH)2]。为了除去铜器表面的铜绿,某同学提出以下三种方案:
Ⅰ.用水洗
Ⅱ.用稀盐酸洗
Ⅲ.加热
溶解性
(
阴离子
阳离子
Cl-
CO32-
Cu2-
不
溶
不
有关
CuCO3?Cu(OH)2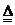 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
反应
CuCO3+2HCl==CuCl2+CO2↑+H2O
仔细查阅上表资料,上述方案最可行的是___________(填序号代码)。
(3)根据化学方程式计算:加热2.22 gCuCO3?Cu(OH)2,使之完全分解,计算剩余固体的质量。
(4)工业上以黄铜矿为原料生产铜时会产生SO2尾气。将SO2直接排放到大气中,溶于雨水会形成___________处理该尾气一般是将SO2循环制备成H2SO4,用氨水吸收。H2SO4与氨水反应生成的铵盐是一种常见氮肥,该盐是___________ (写化学式或名称)。
四、(本题包括2个小题,共22分)
16.(13分)常温下,A、B均为液态,且组成元素相同。生活中,F可用作补钙剂。x是氧化物,y是金属。各物质间的转化关系如图所示(个别产物略去)。
(1)推断:A是_____________;E是_____________ (写化学式)。
(2)反应①常用于_____________;由H和石灰加水可配制农业上常用的杀虫剂波尔多液,波尔多液不能用铁制容器盛放的原因是______________________________
(3)化学变化常伴随颜色改变。上述由物质y―E―H(溶液)的过程中,颜色变化为_____________色→_____________色→_____________色;
(4)写化学方程式:④_______________________________________
⑥_________________________________________________________________
(5)反应④结束后,从混合物中分离出F的方法是_____________;鉴别D溶液和G溶液的方法是_________________________________________________________________
17.(9分)某化学实验小组拟用以下装置进行气体制备的研究。




(1)以KClO3为原料制O2时,应选装置___________(填字母序号);化学方程式为
__________________________________________________________________
(2)实验室制取CO2的化学方程式为___________;为了检验是否有CO2生成,某同学将制得的气体通人紫色石蕊溶液。该操作___________ (填“可行”或“不可行”);理由是
__________________________________________________________________
(3)可用装置D收集的气体是___________ (填一种气体的名称)。
(4)因反应速率较快,实验室通常不用碳酸钠和稀盐酸反应来制取CO2,但若用装置C则可。为了便于收集CO2,与装置B比较,C装置的显著特点是_____________________
五、(本题只有1个小题,共10分)
18.(10分)为了测定实验室某生锈铁片中铁元素的质量分数,两位同学分别设计了如下甲、乙两个实验方案。
方案甲:称得生锈铁片的质量为m
方案乙:称得生锈铁片的质量为m

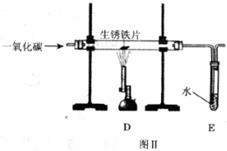
(1)称量时,应将铁片放在托盘天平的_____________盘(填“左”或“右”);两位同学使用托盘天平,分别称得铁片质量为2.
(2)[评价交流]上述两个方案中,可行的是________ (填“甲”或“乙”);分析不可行方案,其缺陷是________________________________________________________
(3)[设计实验]方案乙中,同学们设计了如下实验报告,请帮助完成。
实验编号
实验步骤
实验现象
结论或化学方程式
①
装置Ⅱ
通入CO,加热。完全反应后,停止加热,继续通CO至室温
生锈铁片变成光亮的银白色
CO具有________性;反应结束后,还要继续通CO至室温的目的是___________
化学方程式:_________。
②
装置I
将光亮铁片放人稀盐酸中,完全反应
溶液颜色由无色变成浅绿色,有气泡放出
化学方程式:________
(4)[提出问题]图Ⅱ所示装置是否有可改进之处?
请简要叙述具体改进意见,或在图Ⅱ中画出简易装置示意图。
___________________________________________________________________
(5)[结论]生锈铁片中铁元素的质量分数是________ (用字母表示)。