2008年江苏省镇江市初中毕业升学统一考试
化学试卷
说明:
1.本试卷满分100 分。考试时间100 分钟.
2.可能用到的相对原子质量:H ―
Ca―40 Fe―56 Ba―137
一、选择题(本题包括16 小题.每小题2 分,共32 分。每小题只有一个选项符合题意)
2.下列日常生活中的物质属于纯净物的是
3.用化学的观点解释下列成语,错误的是
A.十年树木:树木生长,无化学变化
B.花香四溢:分子在不断运动
C.釜底抽薪:将可燃物撤出燃烧区
D.百炼成钢;逐渐降低生铁中碳、硅等含量
4.生活中的下列物品,用合成材料制作的是
A.铝合金门窗 B.玻璃钢桌椅
C.塑料洗衣盆 D.景德镇瓷器
5.现对①碳酸氢铵;②生石灰;③甲烷;④烧碱;⑤酒精;⑥镁;⑦干冰;⑧棉花;⑨维生素C ; ⑩红磷等物质进行分类.下列分类正确的是
A.单质.⑥ ⑦ B.有机物:③ ⑤ ⑧ ⑨
C.氧化物:② ⑩ D.盐:① ④
6.下列有关人体生理活动的叙述.错误的是
A.代谢产生的CO2如不能及时排出,会使血液的pH 增大
B.无机盐和水虽不能提供能量,却是人体必需的
C.胃液中少量的盐酸可以帮助消化
D.香烟烟气中的CO 会使血红蛋白携氧能力降低
7.“绿色化学”要求从根本上减少或杜绝污染。下列做法中符合绿色化学理念的是
A.实验中未说明药品用量时,取用较多量药品进行实验
B.实验室将废液直接倒入下水道
C.对废旧电池作深埋处理,消除其污染
D.化工生产中使原料尽可能地转化为产品
8.下列主题知识的归纳中,正确的一组是
A.生活常识
B.安全常识
用铁锅烹调食物→防止贫血
蛋白质摄入过少→使人生长发育迟缓等
煤气泄漏→先打开排气扇
海鲜防腐→甲醛溶液浸泡
C.物质鉴别
D.环保知识
蚕丝布料和化纤布料→点燃
加碘食盐和无碘食盐→淀粉溶液
臭氧层空洞→温室效应
过度施用农药、化肥→水污染和土壤板结
9.今年春节前.我省发生了特大冰雪灾害,为确保道路畅通,交通部门使用了大量的氯化钠融雪剂.下列关于该融雪剂的说法中,错误的是
A.氯化钠能融雪是因为其溶液的凝固点比水低
B.氯化钠的大量使用会造成地下水污染
C.使用氯化钠融雪,会加快钢铁桥梁的锈蚀
D.使用大量氯化钠融雪,对公路周围农作物的生长无影响
10.为判断某化合物是否含碳、氢、氧三种元素,取一定质量该化合物在氧气中充分燃烧,接下来还需进行的实验有
① 用无水硫酸铜检验是否有水生成
② 用澄清石灰水检验是否有二氧化碳生成
③ 用带火星的木条检验氧气
④ 测定水和二氧化碳的质量
A.① ② ③ B.① ② ④
C.② ③ ④ D.① ② ③ ④
11.铁、稀硫酸、石灰水和氯化铜溶液之间的反应关系如下图所示,图中两圆相交部分(A 、B , C 、D )表示物质间反应的类型或主要实验现象。下列说法错误的是
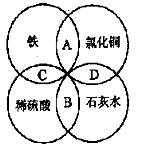
A.A处发生置换反应 B.B处发生复分解反应
C.C处产生气泡 D.D处生成白色沉淀
12.下列实验方案中,可行的是
A.按溶解、过滤、蒸发的操作顺序分离CaCl2、CaCO3的混合物
B.将白醋滴在润湿的pH 试纸上,测定其pH
C.用氢氧化钠溶液除去CO2 以中的HCl气体
D.用BaCl2溶液除去KNO3 溶液中少量的K2SO4
13.下列装置能达到对应实验目的的是
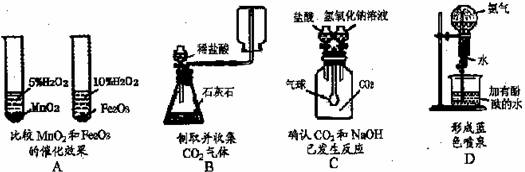
14.对反应X + 3NaOH===3Y 十Fe ( OH )3↓的分析,错误的是
A.X中含有三价元素 B.X可能是Fe2 ( SO4)3
B.Y中一定含有Na元素 D.Y 可能是NaNO3
15.某工厂拟选用下列物质处理含硫酸的废水.
物质
NaCl
CaCO3
Ca(OH)2
NaOH
市场参考价(元/kg)
1.2
1.8
2.0
11.5
现花最少的钱中和等量的废水应选择
A.NaCl B.CaCO
16.下列曲线图与实验事实相一致的是
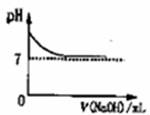
A.向一定体积HCl溶液中滴加NaOH溶液
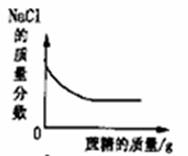
B.t
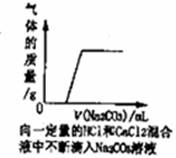
C.向一定量的HCl和CaCl2混合液中不断滴加Na2CO3溶液
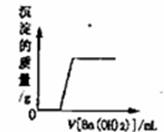
D.向CuCl2和H2SO4的混合液中加入过量的Ba(OH)2溶液
二、选择题(本题包括4小题,每小题2分,共8 分。每小题有1―2 个正确选项.错选、多选不给分,若有两个答案只选一个且正确给1分)
17.A 图是物质M和N的溶解度曲线.B 图中甲、乙试管分别盛有M 、N 的饱和溶液,试管底均有未溶解的M 、N 固体。向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,则加入的物质不可能是
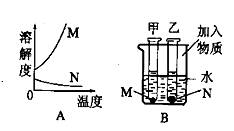
A.浓硫酸 B.硝酸按固体 C.氧化钙 D.氢氧化钠固体
18.下列说法正确的是
A.NaOH 和MgO 的混合物中氧的质量分数为40 % ,则NaOH和MgO的质量一定相等
B.某KNO3 溶液在室温下蒸发
C.一种溶液和一种固体反应,反应后溶液的质量和参加反应的物质的总质量一定相等
D.将质量分数为98%的浓硫酸加入到等质量的水中,所得溶掖的溶质质量分数为49 % ,
19.小华在测定铁在O2中燃烧的产物时,发现
A.Fe3O4和Fe B.Fe2O3和FeO
C.Fe3O4和Fe2O3 D.Fe3O4、FeO 和Fe
20.北京奥运会主体育场的外形像鸟巢.硼烷的结构也像鸟巢,故称为巢式硼烷.五硼烷(B5H9)为传统火箭燃料,燃烧产物对环境污染小,下图是三种巢式硼烷,下列说法正确的是

A.图中M 的名称为九硼烷
B.八硼烷的化学式为B6H12
C.硼烷有可能成为未来的清洁能源
D.2B5H9+12O2 5X + 9 H2O,则X中B的化合价为+5价
5X + 9 H2O,则X中B的化合价为+5价
三、填空题(本题包括5小题,共15分)
21. ( 4 分)用化学用语表示:
① 磷元素 ② 空气中含量最多的气体
③ 3 个铝离子 ④ 葡萄糖
22. ( 2 分)仔细观察下图后回答:

该图反映的环境问题是 ;
请你提一条合理化建议 .
23.( 4 分)用下列序号填空:
① 烧杯② 试管③ 胶头滴管④燃烧匙⑤ 蒸发⑥ 过滤⑦ 搅拌⑧ 量取
能直接加热的玻璃仪器 ;吸取或滴加少量液体的仪器 。
由食盐水制得食盐晶体的操作 ;取用6.8mL 某溶液的操作 .
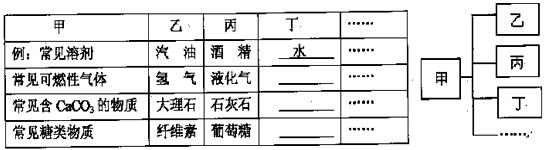
24.(3 分)小陈用下图的形式对所学知识进行归纳,其中甲包含了乙、丙、丁……下表是他对四类物质的具体归类,请你填写丁中的内容:
25. ( 2 分)氢化钠(NaH)与水反应的方程式为:NaH + H2O=== NaOH + H2个。CaH2与NaH 的化学性质相似,用方程式表示CaH2与Na2CO3水溶液发生的化学反应:
26. ( 10 分) 结合图示实验装置,回答下列问题,
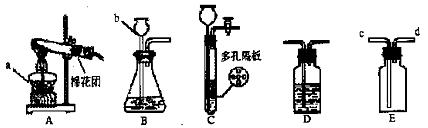
( l )图中a 、b 仪器的名称:a , b 。
(2)用高锰酸钾固体制氧气,选用的发生装置是 (填“A ”、“B ”或“C”),装入药品前应先 ,反应的化学方程式是 。
(3)实验室用B 装置制取二氧化碳时,b 中应加入 .要获得干燥的二氧化碳,除发生装置外,还应选用盛放 的D 装置。如用E 装置收集CO2,则气体应从 端通入(填“ c ”或“d”).
(4)用块状固体和液体不加热制取气体时,改用C 装置(多孔隔板用来放块状固体)代替B 装置的优点是 (答出一点那可)。
27.( 8 分)草酸晶体(H
(l)猜想与假设:
第一种:草酸分解生成CO2和H2 ,第二种:草酸分解生成CO2、CO 和H2O;
第三种:草酸分解:H CO2↑+H2O(未配平)
CO2↑+H2O(未配平)
有同学从理论上就可判断第三种假设不成立,老师也认为这一判断是正确的,该同学判断的理论依据是
( 2 )设计与实验:
甲、乙两同学分别设计了下图所示的A 、B 两套实验装置(图中铁架台略去).
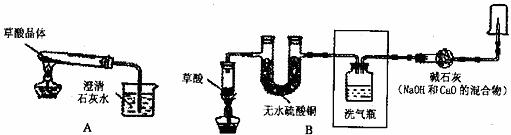
① 甲同学按A 装置实验,观察到澄清石灰水变浑浊,认为此现象是由草酸晶体受热分解产生的CO2所导致,此判断 (填“严密”或“不严密”) .
② B装置图方框内的仪器未画完整,请你帮他画完整。
乙同学按B装置实验,看到无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊,在尖嘴管口点燃剩余气体,火焰上方罩一个 烧杯,有白色固体生成,证明产物中有 ;换一干、冷的烧杯罩在火焰上方,内壁无现象,证明产物中无H2。
(3)结论与思考:
①草酸受热分解的化学方程式为:
②若省略B装置方框内的仪器,整套装置也能证明产物中有CO2(假设每步反应均完全),方法是:
五、推断题(本题包括2 小题.共12 分)
28.(5 分)两种溶液混合,生成了一种沉淀。用酸碱盐的知识回答下列问题。
(1)若两种溶液均为无色,生成的白色沉淀不溶于稀硝酸,则两种溶液中的溶质可能是和 和 ;
(2)若两种溶液均为无色,生成的白色沉淀溶于稀硝酸且有气体产生,则两种溶液中的溶质可能是 和 。
(3)若一种溶液有色,另一种无色,生成的沉淀溶于稀盐酸且无气体产生,沉淀可能是
29.(7 分)下图表示某些物质间转化关系(反应条件和部分产物已省略)其中A 、E 为固体氧化物,且A 为黑色粉末;B 、D 是由相同元素组成的无色液体,且B 其有消毒杀菌作用;其中C 、Y 、Z 为无色气体, 其中Y 有毒.X 是最常见的金属。
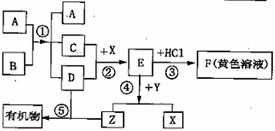
请回答下列问题:
(1)反应① 中A 的作用是
(2)反应③ 、④ 的化学方程式:③ ④
(3)在日常生活中为防止反应②的发生,可采取的措施是__________(写一点即可);
(4)在自然界中普遍存在反应⑤,其名称为__________________;
六、综合题
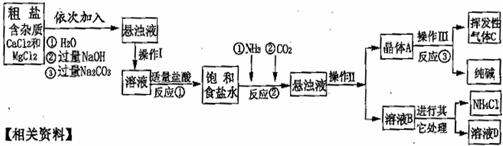
30.( 15 分)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【产品与原理】 该厂采用“侯氏制碱法”生产化工产品――纯碱(Na2CO3)和化肥NH4Cl 。生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:NaCl(饱和)+ NH3+CO2+ H2O====NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【生产流程】
【相关资料】
(1)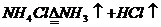
(2)已知

【问题讨论】
(l)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为 .
(2)反应① 中发生了两个反应,写出其中的一个化学方程式:
(3)反应③ 中得到纯碱的化学方程式为, .
(4)溶液B 中的溶质有 (至少写出两种).
(5)上述生产流程中可循环使用的是 (填序号).
A.挥发性气体C B.溶液D
C.氢氧化镁 D.化肥NH4Cl
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化.
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3,溶掖,有白色沉淀.
由上述实验可确定纯碱样品含有杂质 (写化学式).
【含量测定】
称取纯碱样品10.g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为
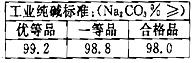
计算过程:
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是___________________________________________________.