2008年江苏省南京市初中毕业生学业考试
化学试卷
可能用到的相对原子质量: H―1 C―12 N―14 O―16 Mg―24 Al―27 Cl―35. 5 Cu―64
一、选择题(本题共15小题,每小题只有一个选项符合题意。每小题1 分,共15 分)
1.宁宁在学习“化学元素与人体健康”后,查阅到如下资料,请你给下表的“★ ”处选择恰当的选项

A.元素 B.分子 C.原子 D.离子
2.下列物质属于氧化物的是
A.O2 B.CO C. KClO3 D.CH3COOH
3.当前高效能的砷化嫁(GaAs)太阳能电池,产生能量的效率高达33%。已知GaAs中,As元素化合价为-3价,则Ga元素的化合价为
A.-1 B.+
4.下列图示实验操作中,正确的是
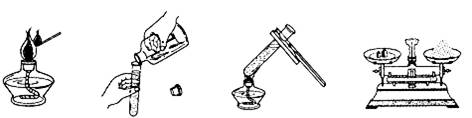
A.点燃酒精灯 B.取少量液体 C.加热液体 D.称取氯化钠
5.今年6 月1 日起全国执行“限塑令”,南京市曾在鼓楼广场等地组织宣传活动,发放无纺布袋。生产无纺布的主要原料为:聚丙烯、聚醋和粘胶等。下列有关说法不正确的是
A.大部分塑料在自然环境中很难降解
B.使用无纺布袋有利于减少“白色污染”
C.生产无纺布与棉布的原料都是天然纤维
D.聚乙烯、聚丙烯、聚酯都属于合成材料
6.下列变化中,属于物理变化的是
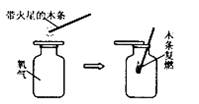
A.氧气使带火星的木条复燃
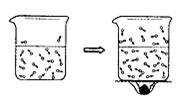
B.水受热蒸发
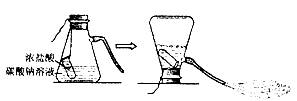
C.液体混合产生气体
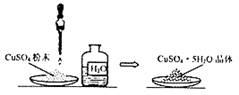
D.白色粉末变成蓝色晶体
7.下列做法不会危及人体健康的是
A.把霉变大米淘净后继续食用 B.用甲醛水溶液浸泡水产品
C.根据医嘱适量服用补钙剂 D.用聚氯乙烯做食品包装袋
8.氢是新型清洁能源,但难储运。研究发现,镧和镍的一种合金是储氢材料。下列有关57 号元素镧(La)的说法不正确的是
A.该元素原子的质子数为57 B.该元素原子的核电荷数为57
C.该元素原子的核外电子数为57 D.该元素为非金属元素
9.
A.氯化钾KCl B.碳酸氢铵NH4HCO3
C.尿素CO ( NH2 )2 D.磷矿粉有效成分Ca3 ( PO4 )2
10.常温下,在
A .15 % B.20 % C.25 % D.33 . 3 %
11.抗震救灾,众志成城。用于坟川震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分为三氯异氰尿酸(C3O3 N3 Cl3 ) ,又称高氯精。下列有关高氯精的说法不正确的是
A.高氯精由4 种元素组成
B.高氯精中C 、O 、N 、Cl 的原子个数比为1┱1┱1┱l
C.高氯精中C 、N 两种元素的质量比为12┱14
D.高氯精中氯元素的质量分数为25 %
12.现有① 液态氧;② 铁锈;③ 食盐水;④ 小苏打;⑤ 氢氧化钾;⑥ 石油。对上述物质的分类全部正确的是
A.盐――③ ④ B.纯净物――④ ⑤ ⑥
C.碱――① ⑤ D.混合物――② ③ ⑥
13.下列说法正确的是
A.分子是构成物质的粒子,因此物质都是由分子构成的
B.某雨水的pH 小于5. 6 ,因此雨水中溶解的是SO2
C.C60和石墨的组成元素相同、原子排列方式不同,因此它们的性质存在差异
D.化学反应常常伴随着能量变化,因此有能量变化的都是化学反应
14.下列物质长期露置于空气中,因发生化学变化而使溶液质量减少的是
A.浓硫酸 B.石灰水 C.浓盐酸 D.氯化钠溶液
15.在反应
A. 4┱9 B.8┱
二、选择题(本题共5 小题,每小题有一个或二个选项符合题意。错选、多选不给分。有二个答案的,只选一个且正确,给1分。每小题2分,共10分)
16.第29 届奥运会将于今年8 月在我国举办,本届奥运会倡导“绿色奥运、科技奥运、人文奥运”的理念。下列选项符合“绿色奥运”理念的有
A.采用丙烷(C3 H 8)作火炬燃料
B.所有奥运用品和食品都是绿颜色的
C.把环境保护作为奥运设施规划和建设的首要条件
D.奥运场馆建设均使用天然材料,不使用合成材料
17.对下列实验事实的解释正确的是
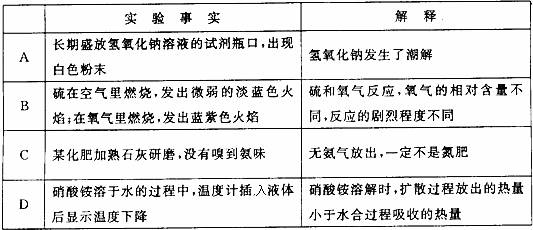
18.下图是a 、b 、c、d 四种固体物质的溶解度曲线;下表是这些固体物质在部分温度时的溶解度。
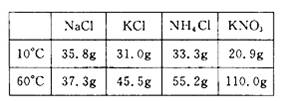

根据图表信息判断下列说法正确的是
A.图中a 曲线表示KNO3 的溶解度曲线
B.b 的溶解度小于a 的溶解度
C.要从a 与d 的混合物中得到a ,通常采用蒸发溶剂使其结晶的方法
D.KCl 的不饱和溶液由
19.某无色气体可能含有CO2、CO 、H2中的一种或几种,依次进行以下实验(假设每步反应均完全进行):① 通过赤热的炭层后,恢复到原状态,气体体积不变;② 通过灼热的CuO 时,固体变成红色;③ 通过白色CuSO4粉末时,粉末变成蓝色晶体;④ 通入澄清石灰水中,石灰水变浑浊。下列判断正确的是
A.原混合气体中一定含有CO2、CO 、H2
B.原混合气体中一定没有CO2,一定含有H2和CO
C.原混合气体中一定含有H2和CO2 ,可能含有CO
D.根据① ④ ,可推断实验过程中一定有CO2生成
20.右下图中连线两端的物质在通常情况下可以相互反应。下列四组选项中,符合该图要求的是
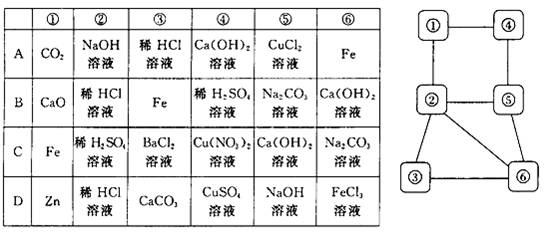
三、(本题包括2 小题,共12 分)
21.( 5 分)请根据下列装置图,回答有关问题:
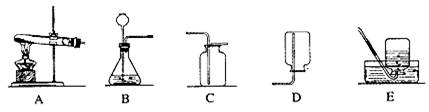
(1)实验如B 、C装置制取二氧化碳的化学方程式为
(2)实验室用高锰酸钾制取氧气,可选用的发生装置是 (填字母)。
(3)实验室收集氢气可用D 或E 装置的原因分别是 、 。
(4)实验室收集二氧化碳时,验满的方法是 。
22. ( 7 分)南南同学跟妈妈学烧紫甘蓝(紫卷心菜),用油炒后加入食醋,发现紫色的叶片立即变红,激发了他的探究欲望。
[提出问题]紫甘蓝的汁液能作酸碱指示剂吗?
〔进行实验〕取紫甘蓝叶片少许在研钵中捣烂,用少量水浸泡,滤出蓝紫色的汁液。将汁液分别滴入下列液体中,观察其显示的颜色并记录。

[得出结论l]紫甘蓝的汁液 (选填“能”或“不能”)作酸碱指示剂。
[质疑并求证] 紫甘蓝的汁液在均为碱性的肥皂水和纯碱溶液中,为何显示不同颜色?用pH 试纸测得上述肥皂水和纯碱溶液的pH 分别为9 和11 ,则肥皂水的碱性比纯碱溶液的碱性(选填“强”或“弱”)
查阅资料:
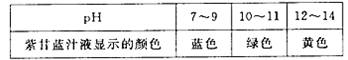
[得出结论2 ] 紫甘蓝的汁液在不同pH 范围内显示的颜色不同,利用紫甘蓝的汁液还可以区分液体碱性的
[拓展应用]柠檬酸是制汽水的原料之一,为探究其固体是否显酸性,南南同学联想到教材上二氧化碳相关实验的设计,准备了三朵用紫甘蓝的汁液染成蓝紫色的干燥小花。
取干燥的花① 和喷上水的花② ,分别放入盛满二氧化碳的两个集气瓶中,发现花① 不变色,花② 变成了 色。在干燥的花③ 上直接撒少量柠檬酸固体,花不变色,说明了 ;再向该花喷水,蓝紫色的花上出现了红色。
[反思]上述花的变色均与水有关,水的作用分别是:
花② 中 ;
花③ 中 。
四、(本题包括3 小题,共13 分)
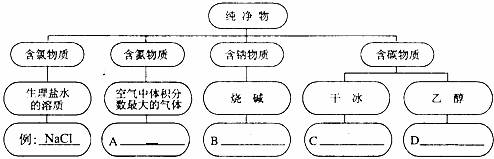
23.( 4 分)请模仿示例,在空格处填上适当的化学式:
24.(2分)今年5 月27 日上午10 点23 分,著名排球运动员孙明在南京鼓楼公园点燃
了奥运圣火盆。根据所学知识,你认为燃烧需要的三个条件是:
(1) ;(2) ;(3)达到燃烧所需的最低温度(也叫着火点)。
25.(7分)2008 年“中国水周”活动的宣传主题为“发展水利,改善民生”。

(1)① 水 (填“属于”或“不属于”)六大类营养素之一。
② 保持水的化学性质的最小粒子是
(2)上图是活性炭净水器示意图,其中活性炭的作用是:不仅可以 的物质,还可以 的杂质。
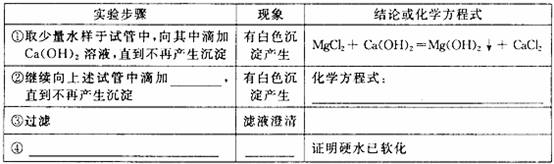
(3)有一杯主要含有MgCl2和CaCl2的硬水。某兴趣小组设计出软化水的部分实验方案,请你一起来完成。
可供选用的物质有:Ca(OH)2溶液、NaOH 溶液、饱和Na2CO3 溶液、肥皂水
五、(本题包括2 小题,共15 分)
26.(4分)下图是初中化学中常见物质间的转化关系,其中甲、乙、丙均为非金属单质;A 、B 、E 和丁均为化合物;B 和E 为能产生温室效应的气体。

(l)写出化学式:
甲 ;乙
(2)写出丙和E 反应生成A 和B 的化学方程式:
(3) D 和A 是组成元素相同的化合物,写出D在丁做催化剂条件下,分解生成A和丙的化学方程式:
27.(11分)镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水提镁是国际上的主要趋势,工业流程图如下:
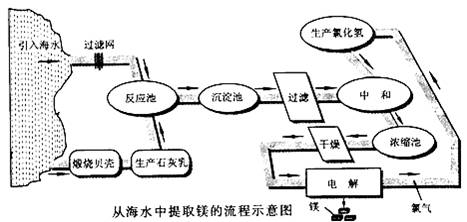
其步骤为:
Ⅰ.将海边大量存在的贝壳(主要成分为CaCO3 )锻烧成生石灰,并将生石灰制成石灰乳Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2?6H2O
Ⅳ.将MgC12?6H2O 在一定条件下加热得到无水MgCl2
V.电解熔融的无水MgCl2 可得到Mg
(1)请根据上述步骤回答问题:
① 写出步骤I 、Ⅲ 的有关化学方程式:
Ⅰ.贝壳锻烧成生石灰
Ⅲ.Mg(OH)2 沉淀中加入盐酸中和
② 步骤Ⅰ―V 中有分解反应的是(填写步骤序号): 。
③ 步骤Ⅲ中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有 、 、酒精灯、带铁圈的铁架台、坩埚钳等。
④ 上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?请写出其中一点: 。
(2)回答下列问题:
① 下图为镁元素的某种粒子结构示意图,该图表示(填序号)
A.分子 B.原子 C.阳离子 D.阴离子

② 镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或“不活泼”) 金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应。
(3)为测定约含镁30%的镁铝合金(不含其它元素)中镁的质量分数。
① 第一小组设计下列实验方案:称量ag镁铝合金粉末,放在如下图所示装置的惰性电热板上,通电使其充分灼烧。
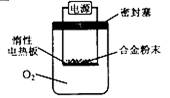
讨论一:欲计算镁的质量分数,该实验中还需测定的一种数据是 。讨论二:若用空气代替O2 进行实验,对测定结果(填“有”或“无”) 影响。② 第二小组设计下列实验方案:称取bg镁铝合金,与足量的稀盐酸完全反应。欲计算镁的质量分数,该实验中还需测定的一种数据是 。
六、(本题包括1小题,共15分)
28.(15分)京京同学对金属活动性顺序等知识进行了研究。
(1)根据下图中的实验现象判断,稀盐酸里的A 、B 、C 、D 四种金属中,在金属活动性顺序里,位于氢后面的金属是(填字母)

(2)将甲、乙两种金属片分别放入硫酸铜溶液中,乙表面析出红色固体,甲没有明显现象。判断甲、乙、铜三种金属的活动性由强到弱的顺序为
(3)查阅资料:金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原。在下列① ②中各写一个化学方程式,③中写出还原金属氧化物的方法。

(4)查阅资料:在金属活动性顺序里,位于氢后面的金属Cu ,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:
3Cu + 8HNO3(稀)= 3Cu(NO3)2+ 2NO↑+4H2O
反应生成的NO是无色、难溶于水的气体,在常温下与空气中的O2迅速化合生成NO2 , NO2是红棕色、有刺激性气味的有毒气体。
用下图所示实验装置进行实验,可以证明铜与稀硝酸反应生成的气体是NO。
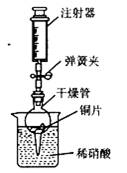
① 检查装置的气密性:关闭弹簧夹,将干燥管放入带有水的烧杯中,若观察到 则表明该装置的气密性良好。
② 按上图所示进行实验:打开弹簧夹,用注射器慢慢抽取干燥管内的气体,稀硝酸沿着干燥管慢慢上升,直到 停止抽拉注射器,关闭弹簧夹,观察干燥管内的现象: 反应停止后,打开弹簧夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的气体推出),关闭弹簧夹后取下注射器,并抽取一定量的空气,观察到气体变为红棕色。
③ 上述实验完成后,用足量NaOH 溶液将气体吸收,其目的是
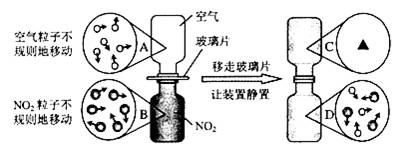
④ 下图是NO2气体和空气混合的实验示意图,观察图中A 、B 、D 的表示方法,在C 处画出相应的气体组成的粒子示意图。
⑤ 在3.
(请写出计算过程)