2007年辽宁省大连市初中毕业升学统一考试化学
(满分l00分,考试时间l20分钟)
可能用到的相对原子质量:H一1 C―12 N一14 O一16 S―32
一、选择题(本题共18小题。每小题l分,共18分,每小题只有一个选项符合题意)
1.下列变化中,属于化学变化的是 ( )
A.石蜡熔化 B.矿石粉碎 C.纸张燃烧 D.酒精挥发
2.大米和面粉中,富含的营养素是 ( )
A.蛋白质 B.糖类 C.油脂 D.维生素
3.下列物质中,属于纯净物的是 ( )
A.空气 B.白醋 C.氯酸钾 D.铝土矿
4.下列化肥中.属于复合肥料的是 ( )
A.(NH4)2SO4 B.NH4H2PO4 C.Ca3(PO4)2 D.KCl
5.下列物质中,不属于空气污染物的是
A.二氧化硫 B.二氧化氮 C.氮气 D.可吸入颗粒物
6.下列各组元素中,都属于人体必需微量元素的是 ( )
A.铁、氧 B.锌、碘 C.钠、氢 D.氟、碳
7.下列物品中,不属于有机合成材料制品的是 ( )
A.塑料袋 B.尼龙绳 C.腈纶衫 D.玻璃杯
8.下列固态物质中,是由分子构成的是 ( )
A.干冰 B.金刚石 C.铜 D.氯化钠
9.实验室里配制一定溶质质量分数的硫酸钠溶液时,有下列操作,其中错误的是 ( )
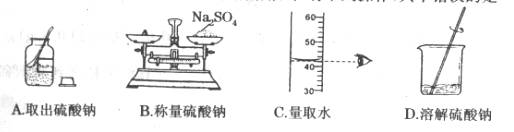
10.下列净化水的方法中,一定能使硬水变为软水的是
A.沉淀 B.过滤 C.吸附 D.蒸馏
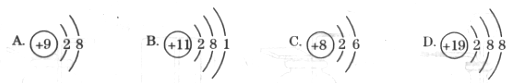
11.下列粒子结构示意图中,表示阴离子的是
12.某同学对水的有关知识进行了下列总结:
①水是由氢元素和氧元素组成的;
②水是无色、无味的液体;
③水在通电条件下能分解,水能与二氧化碳等物质反应;
④水资源短缺已成为制约经济发展的重要因素之一。其中正确的是 ( )
A.只有②④ B.只有①②③ C.只有①③④ D.①②③④
13.胃酸过多时可服角抗酸药片。下列物质可作为抗酸药片有效成分的是 ( )
A.食盐 B.蔗糖 C.碳酸氢钠 D.氢氧化钠
14.下列关于化石燃料及其产品的叙述中,正确的是 ( )
A.天然气是可再生能源
B.通常石油直接用作燃料
C.煤气和液化石油气的组成相同
D.汽油既是燃料,又是良好的溶剂
15.古人曾将铅锻打成细细的铅条,作为笔来写字,这也是“铅笔”名称的由来。铅条能像现代铅笔一样写字,这一现象与铅的下列哪条性质有关 ( )
A.硬度小 B.熔点低 C.密度大 D.能导电
16.农业生产中常用溶质质量分数为16%的氯化钠溶液来选种。对该溶液理解正确的是 ( )
A.溶液中含氯化钠l6g B.溶液质量为l00g
C.每l00g溶液中含氯化钠16g D.每l00g水中含氯化钠l6g
17.国家规定废水排放的pH范围:6<pH<9。某工厂废水的pH为10.5,要使其pH达到允许排放的范围,下列措施不可行的是 ( )
A.加入适量的石灰石粉末 B.加入适量的稀硫酸
C.通入适量的二氧化碳气体 D.加入适量的酸性废水
18.联肼(N2H4)和一氧化氮(NO)反应产生的能量可以作为火箭发射的动力,反应后生成两种物质,其中一种是空气中含量最多的气体,另一种是植物光合作用的原料之一。则两种物质是 ( )
A.N2和CO2 B.N2和H2O C.N2和O2 D.O2和H2O
二、填空题(本题共9小题,每空1分,共27分)
19.请从①甲醛、②亚硝酸钠、③黄曲霉素三种物质中,选择适当物质,将其序号填入相应空白处。
(1)容易被当作食盐而误食的有毒物质是_____________;
(2)家庭装修材料中,容易挥发出的有毒物质是_____________;
(3)大米、花生、面粉等发生霉变而产生的有毒物质是_____________。
20.医用葡萄糖注射液的溶质是_____________,溶剂是_____________。
21.在化学反应中,不仅有新物质生成,还有能量的转化。分别举出利用化学反应产生热能、光能的一个实例(两个实例不能重复)。
热能:________________________________________________
光能:________________________________________________
22.生活中的一些物质含有酸。例如,柠檬汁中含有柠檬酸、食醋中含有醋酸、汽水中一定含有________酸,其水溶液pH均(填“大于”“小于”或“等于”) _____7,都能使紫色石蕊试液变成______色。
23.根据下列现象,说明分子具有的性质。
(1)常温下,一定量气体受压时体积变小:________________________________________;
(2)常温下,敞口容器中的水会逐渐减少:________________________________________。
24.图示是元素周期表的一部分。
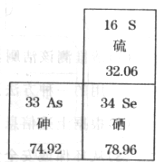
(1)原子序数为33的元素属于(填“金属”或“非金属”) _____元素。
(2)+6价硫元素氧化物的化学式为_____。
(3)硒是人体必需的微量元素之一。缺硒可能引起癌症,若摄入量过高,又会使人中毒,由此得到的启示是_______________________________。
25.熟石灰是常见的碱,在生产中有很多用途。
(1)由生石灰制取熟石灰的化学方程式为 ____________________________。
(2)用石灰沙浆抹墙,墙面逐渐变得坚固,反应的化学方程式为______________。
(3)除上述用途外,再举出一个应用熟石灰的实例:______________。
26.青铜、黄铜、白铜都是铜的合金,具有重要的用途。
(1)工业上用青铜制造轴承、齿轮,而不用纯铜,其原因之一是青铜的硬度比纯铜的硬度(填“大”或“小”)______________。
(2)黄铜主要由铜、锌组成,要除去黄铜粉末中的锌,可以加入足量的稀盐酸,反应 的化学方程式为____________________________。
(3)白铜可用于制造钱币,可以推测白铜具有的性能之一是______________。
27.写出下列反应的化学方程式,并注明反应的基本类型。
(1)氢气用作高能燃料;
____________________________、______________。
(2)在实验室常用加热高锰酸钾的方法制取氧气;
____________________________、______________。
(3)含氢氧化钠的废液可用于吸收氯碱厂尾气中的氯化氢气体
____________________________、______________。
三、回答下列问题(本题共6小题,共21分)
28.(3分)随着经济的发展,人类向大气中排放的气体越来越多,气候也在不断变化,我国已经历了多个“暖冬”。
(1)造成气候变暖的主要物质是______________。
(2)请举出防止“暖冬”现象进一步加剧的两项具体措施。____________________________。
29.(4分)火灾能给人们带来巨大的危害。发生火灾时,根据可燃物的种类不同,选择的灭火剂也有所不同。水是常用的灭火剂,但有的火灾不能用水灭火。
(1)木材着火可以用水扑灭,当水接触燃烧物时,水吸收热量转化为水蒸气,其体积增大1700倍左右,大量水蒸气笼罩在燃烧物的周围,使火焰熄灭。说明其灭火原理。
(2)汽油、煤油、柴油燃烧造成的火灾,不能用水来灭火,其原因是什么?
30.(4分)下列框图中是某品牌“洁厕灵”标签上的部分文字。
一能轻松消除瓷面污渍、水垢、水锈、尿垢等
一勿与漂白类化学品混用
―勿用于酸敏感的大理石、金属等
(1)请推测该洁厕灵呈(填“酸”或“碱”) ______________性。要在家中验证此结论,可采用的一种方法是______________。
(2)根据上述信息,可推知漂白类化学品的一条化学性质是______________。
(3)从环保或安全角度分析,使用洁厕灵时应注意的事项之一是(不能与框图中内容重复)
________________________________________________________。
31.(3分)在我们身边经常有化学反应发生,有时我们希望反应快一些进行,但有时也希望反应慢一些进行。
(1)铁质菜刀容易生锈,为减缓菜刀的锈蚀,可采取的一种措施是______________。
(2)铁制品所处的环境不同,生锈速率可能不同。影响铁制品生锈速率有多种因素,请具体说明其中的两种因素。__________________________________________。
32.(4分)根据X、Y、Z三种物质的溶解度曲线(如图所示),指出下列错误的说法,并解释原因。
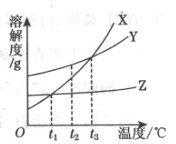
①Y的溶解度随温度升高而增大;
②t1℃时,X与Z的溶解度相等;
③Z中含有少量X时,可用冷却Z的热饱和溶液的方法提纯Z;
④t3℃时,X、Y两种溶液的溶质质量分数不一定相等;
⑤t2℃时,X、Y、Z三种物质各10g,分别加水至恰好溶解,所得饱和溶液质量最大的是Y。 33.(3分)通常情况下,平均每人每天需要消耗氧气约0.9 kg,呼出二氧化碳约1.0 kg。在1.0kg的二氧化碳中含氧元素质量约为0.73kg。假设人体吸入的氧气只用于糖类[以淀粉为例,化学式为(C6H10O5)。]和油脂[以油酸甘油酯为例,化学式为C57H104O6]的完全氧化。根据糖类和油脂的分子构成,解释消耗氧气的质量大于呼出二氧化碳中氧元素质量的原因。
四、实验题(本题共4小题,共21分)
34.(6分)在实验室里可选用下列装置制取二氧化碳气体。
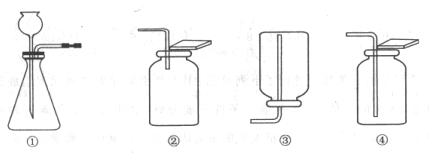
(1)制取气体前,首先要检查装置的 _______________________。
(2)制取二氧化碳的化学方程式为_______________________。
(3)收集二氧化碳气体时,选用的装置序号是_________,理由是________________。
(4)检验二氧化碳气体是否收集满的方法是_______________________。
(5)利用上图中的发生装置,制取另一种气体的化学方程式为_______________________。
35.(5分)图I是实验室里测定空气中氧气含量的装置。
(1)红磷在空气中燃烧的化学方程式为_______________________。
(2)当红磷熄灭并冷却到室温后,打开弹簧夹,看到的现象_______________________。
(3)如果红磷熄灭并没有完全冷却到室温就打开弹簧夹,实验测定结果会偏低。其原因是_____________________________________________________________________。
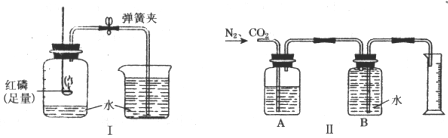
(4)上述实验提供了一种粗略测定混合气体中某种气体体积含量的方法。如果要测定氮气、二氧化碳混合气体中二氧化碳的体积含量,可将一定体积的混合气体样品通人图Ⅱ所示的装置。其中A瓶中装有足量的_____溶液,实验结束后,量筒中水的体积约等于_______的体积。
36.(4分)某同学在实验时发现一瓶盛装氢氧化钠溶液的试剂瓶口有白色粉末,他推测该白色粉末可能是残留在瓶口的氢氧化钠变质形成的新物质。
(1)为验证自己的推测,进行了下列实验:取少量白色粉末滴加稀盐酸,有气泡产生。上述实验可以得出的结论是_________________________________________________。
理由是________________________________________________________。
(2)为进一步探究该白色粉末中是否含有氢氧化钠,该同学又进行了下列实验:取少量白色粉末溶于水,加入澄清石灰水至恰好完全反应。取上层清液滴入酚酞试液,溶液呈红色。
他得出白色粉末中还存在氢氧化钠的结论。你认为是否正确?并说明理由。
37.(6分)某活动小组根据炼铁的反应原理进行模拟实验,在高温下用一氧化碳还原氧化铁,待红色氧化铁完全变成黑色粉末时停止加热,继续通入一氧化碳冷却到室温。为检验生成物,取适量黑色粉末加入足量的硫酸铜溶液,充分反应后,黑色粉末中只有少量的红色固体产生。
为探究一氧化碳还原氧化铁后黑色粉末的组成,查阅到相关资料:铁的氧化物都能与盐酸、硫酸反应,且只有四氧化三铁能被磁铁吸引
(1) 他们提出了猜想①,请你结合所学知识补充余下的两个猜想:
猜想①:该黑色粉末由铁粉和氧化亚铁组成;
猜想②:_______________________________________________________________。
猜想③:_______________________________________________________________。
(2)为验证猜想①,他们取适量黑色粉末加入足量的盐酸,看到黑色粉末完全消失并有气泡产生。该实验能否验证猜想①?并说明理由。
(3)设计实验验证你补充的猜想。
猜想序号
实验操作
可能的现象与结论
②
④
五、计算题(本题共2小题,共l3分)
38.(6分)碳酸二甲酯被称为绿色化学试剂,可以代替光气、硫酸二甲酯等剧毒原料,同时它还是良好的溶剂和燃油添加剂。碳酸二甲酯的化学式为C3H6O3,试计算:
(1)碳酸二甲酯的相对分子质量为_______;
(2)碳酸二甲酯中碳、氢、氧三种元素的质量比为(化成最简整数比) _______;
(3)碳酸二甲酯中碳元素的质量分数为_______。
39.(7分)某化肥厂新生产一批碳酸氢铵化肥,化验室要用稀硫酸检验该碳酸氢铵化肥中的含氮量。
(1)要配制80g溶质质量分数为10%的稀硫酸,需要溶质质量分数为98%的浓硫酸的质量是多少?(计算结果精确到0.1g)
(2)取该碳酸氢铵化肥样品5.0g,加入适量蒸馏水配成溶液,然后向其中加入10%的稀硫酸,当加入27.9g时恰好完全反应(杂质不与稀硫酸反应,且不含氮元素)。反应的化学方程式为:
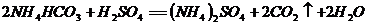
计算5.0g化肥样品中碳酸氢铵的质量。(计算结果精确到0.1g).
(3)计算该碳酸氢铵化肥中氮元素的质量分数。(计算结果精确到0.1%)