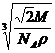安徽省江南十校2009届高三第五次月考(12月)化学试题
一、选择题(本题包括17小题,每小题3分,共51分,每小题只有一个选项符合题意)
1、古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
A、野火烧不尽,春风吹又生
B、春蚕到死丝方尽,蜡炬成灰泪始干
C、粉身碎骨浑不怕,要留青白在人间
D、爆竹声中一岁除,春风送暖入屠苏
2、
A、石墨成为该泡沫陶瓷主要成分的主要原因是石墨是原子晶体
B、石墨成为该泡沫陶瓷主要成分的主要原因是石墨熔点很高
C、石墨中碳碳键之间的夹角是
D、C60也可以代替石墨用作航天飞机表层的防热瓦材料
3、下列离子方程式正确的是( )
A、硫酸氢钠溶液和过量的Ba(OH)2溶液反应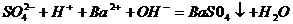
B、碳酸氢钠水解: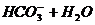 =====
=====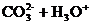
C、氯气和水反应: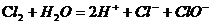
 D、用铂电极电解MgCl2溶液:
D、用铂电极电解MgCl2溶液: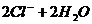

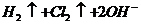
4、下列叙述中正确的是( )
A、干冰气化时碳氧键发生断裂
B、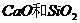 晶体中都不存在单个小分子
晶体中都不存在单个小分子
C、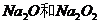 所含化学键类型完全相同
所含化学键类型完全相同
D、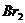 蒸气被木炭吸附时共价键被破坏
蒸气被木炭吸附时共价键被破坏
5、在一个容积VL的密闭容器中,放入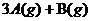 ?
?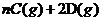 达到平衡后,A物质的量浓度减少
达到平衡后,A物质的量浓度减少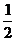 ,混合气的平均摩尔质量增大
,混合气的平均摩尔质量增大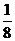 ,则该反应的化学方程式中n的值是( )
,则该反应的化学方程式中n的值是( )
A、1 B、
6、(1)已知PH=2的次碘酸(HIO)溶液与PH=12的NaOH溶液等体积混合,所得溶液呈酸性;(2)001molL-1的HIO3或HMnO4溶液与PH=12的Ba(OH)2溶液等体积混合,所得溶液均呈中性,则下列有关结论不正确的是( )
A、HIO是强酸 B、HIO3是强酸
C、HMnO4是强电解质 D、HIO是弱酸
7、己知稀溶液中,强酸与强碱中和的热化学方程式为:H+(aq)+OH-(aq)=H2O(l);
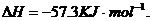 下列各反应放出的热量为573KJ的是( )
下列各反应放出的热量为573KJ的是( )
A、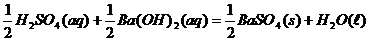
B、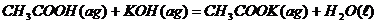
C、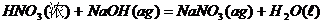
D、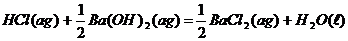
8、北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐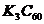 ,实验测知该物质属于离子晶体,具有良好的超导性。下列关于
,实验测知该物质属于离子晶体,具有良好的超导性。下列关于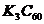 的组成和结构分析正确的是( )
的组成和结构分析正确的是( )
A、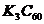 中既有离子键,又有极性键
中既有离子键,又有极性键
B、1mol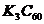 中含有的离子键数目为
中含有的离子键数目为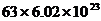
C、该晶体在熔融状态下能导电
D、该物质的化学式可写为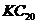
 9、二氧化碳在大气的中含量增大是产生“温室效应”的主要原因。下列反应中不属于自然界缓解“温室效应”的是(
)
9、二氧化碳在大气的中含量增大是产生“温室效应”的主要原因。下列反应中不属于自然界缓解“温室效应”的是(
)
A、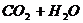 ======
======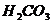

 B、
B、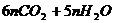
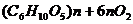

C、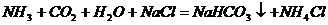

D、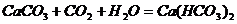

10、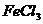 溶液和
溶液和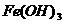 胶体共同具备的性质是( )
胶体共同具备的性质是( )
 A、分散质微粒都能透过半透膜
A、分散质微粒都能透过半透膜
B、用石墨电极做导电性实验时,分散质微粒都定向且朝一个方向移动
C、都有丁达尔现象
D、都比较稳定
11、2006年1月,我国研制出能在超低温状下工作的镍氢电池。镍氢电池的反应式是:

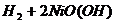
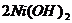 ,根据此反应判断下列叙述中正确的是( )
,根据此反应判断下列叙述中正确的是( )
A、电池放电时,电池负极周围溶液的PH 值不断增大
B、电池充电时,镍元素被氧化
C、电池充电时,镍元素被还原
D、电池放电时,H2是正极
12、可逆反应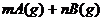 ?
?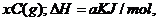 在不同温度和压强
在不同温度和压强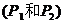 条件下反应物A的转化率的变化情况如图所示。下列判断正确的是( )
条件下反应物A的转化率的变化情况如图所示。下列判断正确的是( )
 A、a>0, m+n>x
A、a>0, m+n>x
B、a>0, m+n<x
C、a<0, m+n<x
D、a<0, m+n>x
13、下列各组离子,在指定的环境中,能大量共存的是( )
A、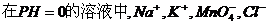

B、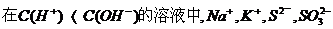

C、在中性溶液中,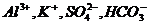

D、在酸性溶液中,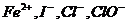

14、用氨水、盐酸、氢氧化钠中的任何一种溶液能鉴别的溶液组是( )
①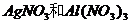 ②
②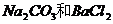

③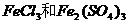 ④
④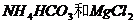

A、只有① B、只有④ C、①和④都能 D、全部都能
15、复印机实际上是一种静电印刷电器,它通过可重复使用的光感器进行工作,在复印机附近会闻到一种特殊气味,离复印机越近气味越浓,若用湿润的KI淀粉试纸检验,则试纸变成蓝色,该气体可能为( )
A、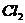 B、
B、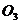 C、
C、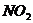 D、
D、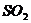
16、“纯净水”“太空水”等商品作为日常饮用水,因缺少某些成分而不利于少年儿童的身体健康,你认为在制备上述商品饮用水时,至少还需要添加的微量物质是( )
A、钙和镁的碳酸氢盐 B、含碘酸盐的食盐
C、漂白粉等消毒剂 D、小苏打
17、A+、B+、C+、D-四种离子两两组成四种可溶性盐,其中:AC 和BD 盐溶液PH=7,BC盐溶液PH>7,则下列说法正确的是( )
A、AD盐溶液PH<7 B、在AC盐溶液中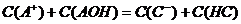
C、碱的电离程度一定是: 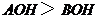
D、酸的电离程度一定是: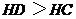
第II卷(非选择题,共57分)
18、(6分)(1)甲、乙、丙是由短周期元素组成的三种单质;
(2)组成乙单质的元素的最外层电子数是次外层的25倍;
(3)C是五核50电子的离子化合物,各物质的关系如下:
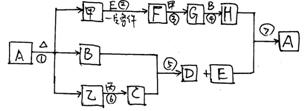
请问答:
1、各物质的化学式:A、 C、 E、
2、写出化学方程式:
(1) 。
(2) 。
(3) 。
19、(8分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体。
(1)B、C两元素按原子个数1:1组成的化合物F中的阴阳离子比为 ,F中既存在离子键又存在 共价键(填“极性”或“非极性”。)
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
>
(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式: 。
(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应,且生成气体的化学方程式: 。
20、(1)氢化铝锂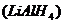 是一种易燃易爆还原极强的络合氢化物还原剂,广泛应用于化工、制药、精细有机化工等行业。在
是一种易燃易爆还原极强的络合氢化物还原剂,广泛应用于化工、制药、精细有机化工等行业。在
①写出氢化铝锂分解反应的化学方程式:
每生成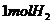 转移电子的物质的量为
转移电子的物质的量为
②氢化铝锂易水解,最初得三种产物,写出其与水反应的化学方程式:
。
(2)在一定温度下,向一个容积不变的容器中,通入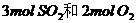 及固体催化剂,使之反应:
及固体催化剂,使之反应: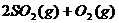 ?
?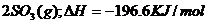 。平衡时容器内气体压强为起始时的90%。此时:
。平衡时容器内气体压强为起始时的90%。此时:
加入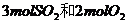 发生反应,达到平衡时,放出的热量为
______。
发生反应,达到平衡时,放出的热量为
______。
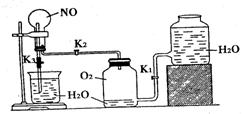 21、(8分)某学生设计了一套验证物质化学性质的实验装置(如下图),请完成下列问题:
21、(8分)某学生设计了一套验证物质化学性质的实验装置(如下图),请完成下列问题:
(1)该实验的目的是
(2)该实验的原理是(用化学方程式表式):
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞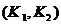 ,止水夹
,止水夹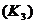 、像皮管、橡皮塞以及若干玻璃管连件外,还有哪几种(写仪器名称):
、像皮管、橡皮塞以及若干玻璃管连件外,还有哪几种(写仪器名称):
。
实验所用试剂为: 。
(4)实验步骤:
①按上图连好仪器
②扭开活塞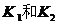 ;主要现象为
。
;主要现象为
。
③关闭活塞  ,打开止水夹
,打开止水夹 ,要使烧瓶内产生喷泉可采用的方法是:
,要使烧瓶内产生喷泉可采用的方法是:
。
22、(6分)据周期表的对角线规则,金属铍与Al单质及其化合物相似,又已知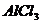 熔沸点较低,易升华。回答下列问题:
熔沸点较低,易升华。回答下列问题:
(1)写出Be与NaOH反应生成NaBeO2的离子方程式
(2)Be(OH) 2和Mg(OH) 2可用 试剂鉴别,其离子方程式为:
(3)BeCl2是 (填写离子化合物或共价化合物)。
(4)Li和Be据对角线规则,性质也相似,则Li在空气中燃烧主要产物是 同时还有少量 生成。
23、(1)肼(N2H4)又称联氨,是一种可燃性气体,可用作火箭燃料。已知在101kpa,
(2)肼―空气燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。
肼―空气燃料电池放电时,正极的电极反应式是
负极的电极反应是 。
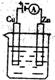 (3)下图是一个电化学过程示意图。
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应式是 ;
②假设使用肼―空气燃料电池作为本过程的电源,铜片质量变化
(4)传统制备肼的方法是以NaClO氧化NH3制得肼的稀溶液。该反应的离子方程式是
。
三、24、(8分)取一定量的Na2CO3、NaHCO3和 的混合物与250ml,100mo1?L-1过量盐酸反应,生成2016LCO2(标准状况),然后加入500ml,0100mo
的混合物与250ml,100mo1?L-1过量盐酸反应,生成2016LCO2(标准状况),然后加入500ml,0100mo
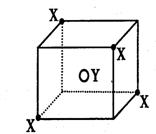 25、(7分)某离子晶体晶胞结构如图,X位于立方体的顶点,Y位于立体中心。试分析:
25、(7分)某离子晶体晶胞结构如图,X位于立方体的顶点,Y位于立体中心。试分析:
 |
(1)晶体中每个Y同时吸引着 个X,每个X同时吸引着 个Y,该晶体的化学式为 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有 个。
(3)晶体中4个X与一个Y所处的位置属于 空间构型。
(4)设该晶体的摩尔量为Mg?mol-1,晶体密度为ρg?cm-3,阿伏加德罗常为NA,则晶体中两个距离最近的X中心间的距离为 cm。
江南十校高三第五次月考(12月)
题号
1
2
3
4
5
6
7
8
9
答案
C
B
A
B
A
A
D
C
C
题号
10
11
12
13
14
15
16
17
答案
D
C
D
B
C
B
A
C
18、1、A:NH4NO
2、①2NH4NO3 =2N2↑+O2↑+4H2O
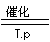 |
②4NH3+502 4NO+6H2O
⑤Mg3N2+6H2O=3Mg(OH) 2↓+2NH3↑
19、(1)1:2 非极性 (2)HClO4>H2SO4 (3)Cl2+2OH-=Cl-+ClO-+H2O
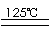 (4)NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑
(4)NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑
20、(1)①2LiALH4 2AL+2LiH+3H2↑ 2mol
(2)LiALH4+4H2O=LiOH+AL(OH)3↓+4H2↑(2分) (3)983kj(2分)
21、(1)验证NO和O2、NO2与水发生的反应。 (2)2NO+O2=2NO2;3NO2+H2O=2HNO3+NO (3)烧杯,圆底烧瓶;HO2、O2、NO (4)②烧瓶内无色气体变为红棕色 ③用热毛巾捂住烧瓶一会儿,再拿开。
22、(1)Be+2OH-=BeO22-+H2↑
(2)NaOH Be(OH)2+2OH-= BeO22-+H2O (3)共价 (4)Li2O Li3N
23、(1)N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
(2)O 2+2H2O+4e-=4H2O+N2↑ (3)①Cu2++2e-=Cu ②112
(4)ClO-+2NH3=N2H4+Cl-+H2O
24、混合物中Na2SO4的质量=
设混合物中NaCO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量
=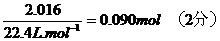
与Na2CO3、NaHCO3反应的盐酸的物质的量为
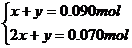 (2分)
(2分)
解得:X=0070mol Y=0020mol
Na2CO3质量=0070mol×
25、(1)4、8、XY2(或写成Y2X)(3分) (2)12(1分) (3)正四角体(1分)(4)