目 录
第一章 化学反应及能量变化
第一课时 氧化还原反应
第二课时 离子反应
第三课时 化学反应中的能量变化 燃烧热和中和热
第二章 碱金属
第一课时 钠及其化合物
第二课时 碱金属元素
第三章 物质的量
第一课时 物质的量和气体摩尔体积
第二课时 物质的量浓度
第三课时 有关物质的量的计算
第四章 卤素
第一课时 氯气及其化合物
第二课时 卤族元素
第五章 物质结构 元素周期律
第一课时 原子结构
第二课时 元素周期律 元素周期表
第三课时 化学键和分子结构
第四课时 非极性分子和极性分子
第五课时 晶体的类型和性质
第六章 氧族元素 硫酸工业
第一课时 氧族元素
第二课时 硫 硫酸
第三课时 接触法制硫酸
第四课时 环境保护 绿色化学
第七章 碳族元素 无机非金属材料
第一课时 碳族元素
第二课时 硅 二氧化硅 无机非金属材料
第八章 氮族元素
第一课时 氮与磷
第二课时 氨 铵盐
第三课时 硝酸
第九章 化学反应速率 化学平衡
第一课时 化学反应速率
第二课时 化学平衡 影响化学平衡的条件
第三课时 合成氨工业 有关化学平衡的计算
第十章 电离平衡
第一课时 电离平衡
第二课时 水的电离和溶液的pH值
第三课时 盐类的水解
第四课时 酸碱中和滴定
第十一章 几种重要的金属
第一课时 金属的概述
第二课时 镁 铝及其化合物
第三课时 铁及其化合物
第四课时 金属的冶炼
第十二章 烃
第一课时 甲烷的性质与“四同”规律
第二课时 不饱和烃的性质与空间构型
第三课时 苯及其同系物的结构和性质
第四课时 有机物的燃烧规律及有机计算
第十三 章 电化学原理
第一课时 原电池原理及其应用
第二课时 电解原理及其应用
第三课时 胶体的性质及应用
第十四 章 烃的衍生物
第一课时 卤代烃的两大反应和基团的移动和保护
第二课时 醇羟基、酚羟基与羧羟基的区别和联系(1)
第三课时 醇羟基、酚羟基与羧羟基的区别和联系 (2)
第四课时 羟基酸、氨基酸、脂肪酸的性质
第五课时 醛、酯的重要性质与拓展
第六课时 有机化学实验探究
第十五章 糖类 蛋白质
第一课时 糖类
第二课时 油脂
第三课时 蛋白质
第十六章 合成材料
第一课时 有机反应规律
第二课时 有机合成方法
第十七章 化学实验方案的设计
第一课时 物质的制备和性质实验方案的设计
第二课时 物质的检验
前 言
本教学案是依据高考化学考试大纲及新课程标准的精神编写的,覆盖了整个高一、高二、高三的学习、教学与备考。
1.自学反馈的内容是要求学生在上课前做好复习工作,对本节课上的知识预先自己复习,并完成有关习题和概念辩析。该内容也是教师在课堂教学中的主干知识,本着重要的内容详讲,次要的内容略讲;学生全会的内容不讲,学生不会的内容细讲的原则进行讲解,建议采用讲练结合的方法。教师也可以把知识点自由组合,自主复习授课。
2.例题解析和考题再现内容是高考的热点、难点和学生的易错点,建议在课堂教学中能重点剖析,总结出解题方法、妙法,找出易错点,举一反三,强化变式训练,搞懂一类。并对高考趋势预测,使复习针对性强。
3.课堂反馈内容要求学生在课堂上完成的,教师可当堂评讲或收交批改,学生也可据此检查课堂学习效率。
4.右侧留下的“笔记与反思”空档,是供老师、学生课堂记录及课后小结用的。可以写上重要的概念和规律、复习过程的心得体会、解题过程、变式习题、重难点、误中思、思中悟等。
5.本教学案采用活页装订,便于收交、批改和讲评,并希望同学们能及时保存好已收交、批改后的教学案,以利于后面的复习。
6.每章后须安排一次与高考相近的规范化练习,不仅考本章的内容(约占60%),也可考已复习过的内容(约占20%)以及没有复习过的内容(约占20%),也可安排一定量的原题重做或变式的原题重做,以检查复习效果。
第 一 章 化学反应及能量变化
第一讲 氧化还原反应及其配平
【考纲要求】
1.理解氧化还原反应的相关概念及这些概念间的相互关系。
2.掌握用化合价升降和电子得失的方法分析氧化还原反应,标出电子转移方向和数目。指出氧化剂、还原剂、氧化产物、还原产物。
3.学会分析氧化剂的氧化性强弱、还原剂的还原性强弱的方法。
4.掌握氧化还原反应方程式的配平方法。
5.掌握用电子守恒法进行氧化还原反应的相关计算。

教与学方案 笔记与反思
【自学反馈】
一、概念辨析
1.化学反应的分类:
。
2.氧化还原反应: 。
(1)氧化剂: 、(2)还原剂 、
(3)被氧化: 、(4)被还原 、
(5)氧化产物: 、(6)还原产物 。
3.规律:
 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O

 教与学方案
教与学方案




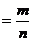
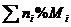

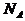 代表阿伏加德罗常数,下列说法正确的是
代表阿伏加德罗常数,下列说法正确的是
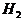 的物质的量为1mol
的物质的量为1mol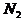 分子质量均为28g
分子质量均为28g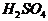 分子和
分子和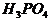 分子中所含氢原子的个数比为1:1
分子中所含氢原子的个数比为1:1



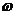 %、ρ之间的计算关系
%、ρ之间的计算关系 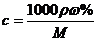

 B
B 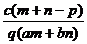 C
C  D
D 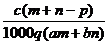


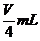 B.
B.
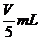 C.
C.
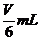 D.
无法判断
D.
无法判断 )
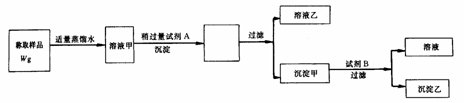
) 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
 教与学方案
教与学方案
 1.Br2是常温下唯一呈液态的非金属单质,易挥发,蒸气有毒。保存液溴 采用水封法。
1.Br2是常温下唯一呈液态的非金属单质,易挥发,蒸气有毒。保存液溴 采用水封法。 


 解题思路:
。
解题思路:
。










 Pa)
Pa)



 易错点:
。
易错点:
。 [例2]如图所示,已知:
[例2]如图所示,已知:
 Fe2O3+SO2+SO3,如将生成的混和气体通过氯化钡溶液,应发生的现象有( )
Fe2O3+SO2+SO3,如将生成的混和气体通过氯化钡溶液,应发生的现象有( )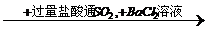 白色沉淀
白色沉淀 白色沉淀
白色沉淀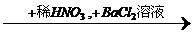 白色沉淀
白色沉淀 无色溶液
无色溶液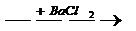 白色沉淀
白色沉淀 2HBr+H2SO4和2HBr+H2SO4(浓)
2HBr+H2SO4和2HBr+H2SO4(浓) 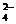
 +2H+
+2H+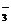 、OH-、Na+
、OH-、Na+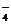 、F e3+、NH
、F e3+、NH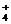 、H+、AlO
、H+、AlO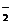 、CO
、CO 考查目的:这是一道信息题,用学习过的化学知识解释实际问题,培养学生解决实际问题的能力。
考查目的:这是一道信息题,用学习过的化学知识解释实际问题,培养学生解决实际问题的能力。 教与学方案 笔记与反思
教与学方案 笔记与反思 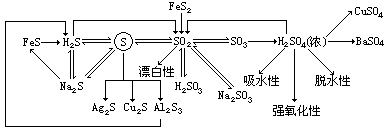

 )
) 铁跟盐酸反应:2Fe+6H+ 2Fe3++3H2↑
铁跟盐酸反应:2Fe+6H+ 2Fe3++3H2↑
 1.讨论:考虑原料和成本等因素,你认为工业合成硫酸的途径如何?
1.讨论:考虑原料和成本等因素,你认为工业合成硫酸的途径如何? (3)几个率:①矿物的纯度=
×100%
(3)几个率:①矿物的纯度=
×100% ③产率=
×100%
③产率=
×100% 出的气体正确的是
( )
出的气体正确的是
( ) 2SO3(g)
,ΔH=
-98.3kJ/mol。下列说法中正确的是
( )
2SO3(g)
,ΔH=
-98.3kJ/mol。下列说法中正确的是
( )  6.在一定条件下,某密闭容器发生如下反应:2SO2(g)+O2(g)
6.在一定条件下,某密闭容器发生如下反应:2SO2(g)+O2(g) 
 [例2]某工厂处理含二氧化硫废气时采用“将二氧化硫转化为硫酸铵”的方法。该厂初步处理后的废气中氧气的体积分数为10%,二氧化硫的体积分数为0.2%。使该废气在400℃时以5m3/h的速率通过催化剂层与速率为20L/h的氨气混合,再喷水使之发生反应,2NH3+H2SO4
[例2]某工厂处理含二氧化硫废气时采用“将二氧化硫转化为硫酸铵”的方法。该厂初步处理后的废气中氧气的体积分数为10%,二氧化硫的体积分数为0.2%。使该废气在400℃时以5m3/h的速率通过催化剂层与速率为20L/h的氨气混合,再喷水使之发生反应,2NH3+H2SO4
 (3)碳酸正盐:稳定性
、
(3)碳酸正盐:稳定性
、






 Si
O2
Ca(HCO3)2
CaCO3
Si
O2
Ca(HCO3)2
CaCO3








 SiC
C
CO2
Na2CO3
SiC
C
CO2
Na2CO3



 CO2↑+Si
CO2↑+Si Na2SiO3+CO2↑
Na2SiO3+CO2↑ Cu+CO2↑
Cu+CO2↑

 加入石膏的作用
;
加入石膏的作用
; 的分子结构为
的分子结构为 ,它在水溶液中不稳定,
,它在水溶液中不稳定,
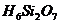 。已知某缩聚硅酸中硅元
。已知某缩聚硅酸中硅元 2.镁橄榄石Mg2SiO4可以用下列哪一种氧化物形式表示
( )
2.镁橄榄石Mg2SiO4可以用下列哪一种氧化物形式表示
( )
 ( a、
b、c均未配平)回答下列问题:
( a、
b、c均未配平)回答下列问题: A.10 B.
12 C.
24 D.
28
A.10 B.
12 C.
24 D.
28
 NH4H是离子化合物,固态时属离子晶体
NH4H是离子化合物,固态时属离子晶体
 C.NaN3与稀硫酸作用生成NH3 D.它与氨气作用生成的是共价化合物
C.NaN3与稀硫酸作用生成NH3 D.它与氨气作用生成的是共价化合物 2.掌握硝酸的工业制法
2.掌握硝酸的工业制法

 【考题再现】
【考题再现】 3.会分析影响化学反应的因素.
3.会分析影响化学反应的因素.
 教与学方案
教与学方案
 系数比。如对:mA +
nB
pC + qD
系数比。如对:mA +
nB
pC + qD
 3C + 4D反应中,表示该反应速率最快的是( )
3C + 4D反应中,表示该反应速率最快的是( ) A VA = 0.5 mol?L-1?S-1 B VB = 0.3 mol ?L-1?S-1
A VA = 0.5 mol?L-1?S-1 B VB = 0.3 mol ?L-1?S-1
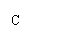
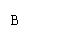


 gG(气)+hH(气);△H=QkJ/mol ,图甲、图乙分别表示在虚线所示部位改变温度(T)或压强对化学平衡与反应速率的影响(t表示时间),则下列结论中正确的是…………………………………( )
gG(气)+hH(气);△H=QkJ/mol ,图甲、图乙分别表示在虚线所示部位改变温度(T)或压强对化学平衡与反应速率的影响(t表示时间),则下列结论中正确的是…………………………………( )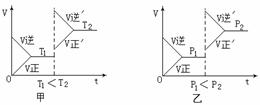
 A、P1>P2 ,n
>3 B、P1>P2
,n <3
A、P1>P2 ,n
>3 B、P1>P2
,n <3 2SO3,如果SO2的起始浓度为2 mol/L ,2min后SO2的浓度为1.8mol/L,则用SO2的浓度变化表示的反应速率为…………………( )
2SO3,如果SO2的起始浓度为2 mol/L ,2min后SO2的浓度为1.8mol/L,则用SO2的浓度变化表示的反应速率为…………………( )


 到达平衡所需时间就越短;(同压强时)
到达平衡所需时间就越短;(同压强时)
 到达平衡所需时间就越短;(同温度时)
到达平衡所需时间就越短;(同温度时)
 到达平衡所需时间就越短;
到达平衡所需时间就越短; 间而变化
间而变化 
 2SO3(气) 平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的容器中反应,反应达平衡时,SO3的物质的量大于n mol的是( )
2SO3(气) 平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的容器中反应,反应达平衡时,SO3的物质的量大于n mol的是( )
 D. 单位时间生成n molA2的同时生成n mol的B2
D. 单位时间生成n molA2的同时生成n mol的B2 
 起始状态时各物质的物质的量/mol
平衡状态时C的物质的量mol-1
起始状态时各物质的物质的量/mol
平衡状态时C的物质的量mol-1  属于非电解质的是
;属于强电解质的是
;属于弱电解质的是
。
属于非电解质的是
;属于强电解质的是
;属于弱电解质的是
。



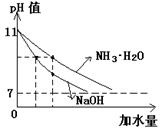

 常用方法:PH试纸法
常用方法:PH试纸法
 B.
B.
 D.
D.
 B.
B.
 (3)不能与HCO3-共存的离子有
、
(3)不能与HCO3-共存的离子有
、 2.分析原理:据c标••••••V标••••n标=c待••V待•n待有n待=
。
2.分析原理:据c标••••••V标••••n标=c待••V待•n待有n待=
。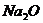 杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知
杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知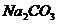 杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未
杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未 课外作业
课外作业



 均具有较强的还原性:
均具有较强的还原性:
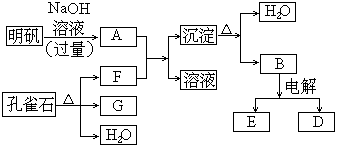
 1、用下面两种方法可以制得白色的Fe(OH)2沉淀。
1、用下面两种方法可以制得白色的Fe(OH)2沉淀。








 Al(OH)3↓ Al(OH)3+OH-
Al(OH)3↓ Al(OH)3+OH-  沉淀增加
沉淀增加
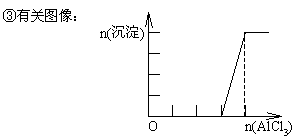

 。
。
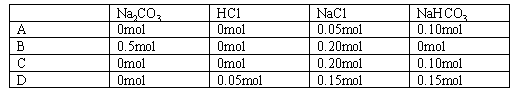

 取不同范围值时,沉淀中各组分的物质的量是多少?
取不同范围值时,沉淀中各组分的物质的量是多少?
 教与学方案
教与学方案 

 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,下列叙述不正确的是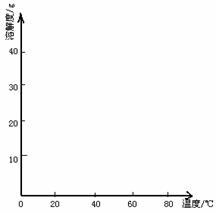

 反应完成后在溶液中滴入NH4SCN溶液使溶液显血红色
反应完成后在溶液中滴入NH4SCN溶液使溶液显血红色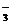 、CO
、CO 。给固体A加水得一无色溶液,再向溶液中加入稀硫酸无反应。从以上实验可得出什么推断,其结论是什么。
。给固体A加水得一无色溶液,再向溶液中加入稀硫酸无反应。从以上实验可得出什么推断,其结论是什么。

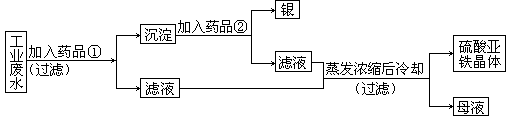


 【考题再现】
【考题再现】


 取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500ml)
( )
取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500ml)
( ) 1.下列关于电解法精炼粗铜的叙述中不正确的是
( )
1.下列关于电解法精炼粗铜的叙述中不正确的是
( ) 


 .
.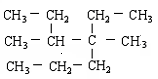 【例2】对于烃
,的命名正确的是:
【例2】对于烃
,的命名正确的是:

 ③
③ A.
A.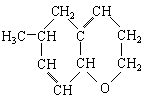 B.
B. C.
C. 思维方法:
。
思维方法:
。 (其中n=0,1,2,3…,的化合物)。式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律性的变化。下列四种
(其中n=0,1,2,3…,的化合物)。式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律性的变化。下列四种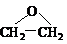 )与乙二醇作用,控制一定的反应条件及反应物的用量比例,可生成一系列双官能团化合物,称为多缩乙二醇醚,其后应原理可表示为:
)与乙二醇作用,控制一定的反应条件及反应物的用量比例,可生成一系列双官能团化合物,称为多缩乙二醇醚,其后应原理可表示为: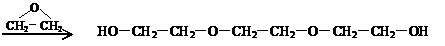
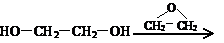
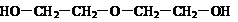
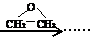
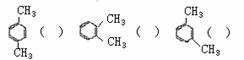
 4.下列各组物质中,互为同分异构体的是 ( )
4.下列各组物质中,互为同分异构体的是 ( )  CH3
CH3
 A.CnI3n-1
B.CnI3m-2
C.CnI3n-3 D.CnI3n-4
A.CnI3n-1
B.CnI3m-2
C.CnI3n-3 D.CnI3n-4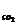 /V
/V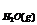 =2的有 、 、 。
=2的有 、 、 。 含有 结构
含有 结构 含有
结构
含有
结构 含有
结构
含有
结构
 (也可表示为:
(也可表示为: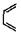 +ㄕ→
+ㄕ→ )
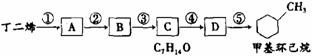
) 实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:
实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:

 已知
已知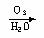


 5.“苯来”―― 苯的制取
5.“苯来”―― 苯的制取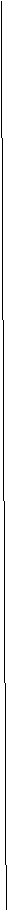 原因:苯环上的邻、对位上的氢原子受羟基的影响而变得很活泼。
原因:苯环上的邻、对位上的氢原子受羟基的影响而变得很活泼。 断键规律:断C-X键 方程式:
断键规律:断C-X键 方程式:
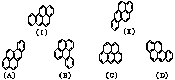 【例2】萘分子的结构式可以表示为
【例2】萘分子的结构式可以表示为 ,两者是等同的。苯并[a]芘是强致癌物质(存在于烟卤灰、煤焦油、燃烧烟草的烟雾和内燃机的尾气中)。它的分子由五个苯环并合而成,其结构式可以表示(Ⅰ)或(Ⅱ),这两者也是等同的现有结构式(A)~(D),其中
,两者是等同的。苯并[a]芘是强致癌物质(存在于烟卤灰、煤焦油、燃烧烟草的烟雾和内燃机的尾气中)。它的分子由五个苯环并合而成,其结构式可以表示(Ⅰ)或(Ⅱ),这两者也是等同的现有结构式(A)~(D),其中 合成芳炔类大环的一种方法是以苯乙炔(CH≡C-
合成芳炔类大环的一种方法是以苯乙炔(CH≡C- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为: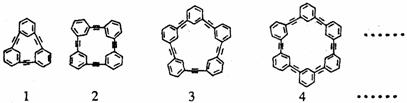
 的过程。
的过程。 (3)1866年凯库勒(右图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列
事实(填入编号)
(3)1866年凯库勒(右图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列
事实(填入编号) 2.萘环上的碳原子的编号如(Ⅰ)式,根据系统命名法,(Ⅱ)式可称为2-硝基萘,则化合物(Ⅲ)的名称应是
( )
2.萘环上的碳原子的编号如(Ⅰ)式,根据系统命名法,(Ⅱ)式可称为2-硝基萘,则化合物(Ⅲ)的名称应是
( )
 3.化合物B3N3H6俗名无机苯,有关它的说明不正确的是
3.化合物B3N3H6俗名无机苯,有关它的说明不正确的是 A.它的结构式可表示为
B.它的结构式可表示为
A.它的结构式可表示为
B.它的结构式可表示为

 5.(2000年春季高考题)烷基取代苯可以被KMnO4的酸性溶液氧化成
,但若烷基R中直接与苯环连接的碳原子上没有C―H键,则不容易被氧化得到
,现有分子式是C11H16的一烷基取代苯,已知它可以被氧化为
的异构体有7种,其中的3种是:
5.(2000年春季高考题)烷基取代苯可以被KMnO4的酸性溶液氧化成
,但若烷基R中直接与苯环连接的碳原子上没有C―H键,则不容易被氧化得到
,现有分子式是C11H16的一烷基取代苯,已知它可以被氧化为
的异构体有7种,其中的3种是:

 a.被酸性高锰酸钾溶液氧化 b.能与溴水发生加成反应,
a.被酸性高锰酸钾溶液氧化 b.能与溴水发生加成反应,
 1.有机物完全燃烧的通式:
1.有机物完全燃烧的通式:


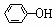
 (1)羟基的引入
(1)羟基的引入

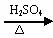
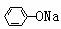
 ⑥酸化法 例:
+ HCl
+H2O
⑥酸化法 例:
+ HCl
+H2O

 ①脱水法 例: CH3CH2OH
CH2=CH2 +H2O
①脱水法 例: CH3CH2OH
CH2=CH2 +H2O
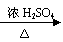 ③酯化法 例:
③酯化法 例: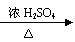

 -OH + NaOH H3C-
-OH + NaOH H3C-
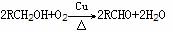
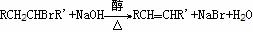

 R-
R- R-
R-



 【例1】在有机反应物中,反应物相同而条件不同可以得到不同的产物,下式中R代表烃基,副产物均以略去(请注意H和Br所加成的位置)
【例1】在有机反应物中,反应物相同而条件不同可以得到不同的产物,下式中R代表烃基,副产物均以略去(请注意H和Br所加成的位置) C2H5Br+H2O
C2H5Br+H2O
 如:
如: 该反应式也可表示为
该反应式也可表示为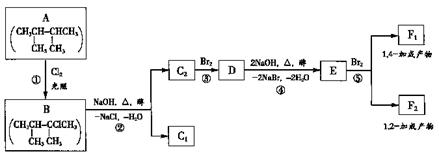
 D.加入NaOH醇溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成
D.加入NaOH醇溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 C.取代-加成-消去
D.消去-加成-取代
C.取代-加成-消去
D.消去-加成-取代 A.m+n=6 B.m=n C.2m=n
D.m+n=8
A.m+n=6 B.m=n C.2m=n
D.m+n=8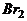 发生加成反应,产生二溴衍生物B;B用热的NaOH-乙醇溶液处理得到化合物C;经测试知C的结构中含有两个双键,化学式是
发生加成反应,产生二溴衍生物B;B用热的NaOH-乙醇溶液处理得到化合物C;经测试知C的结构中含有两个双键,化学式是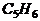 ;将C催化加氢生成环戊烷。写出A、B、C的结构式。
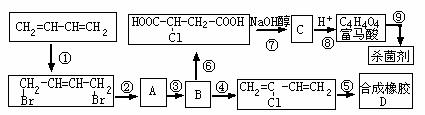
;将C催化加氢生成环戊烷。写出A、B、C的结构式。 2.(04年广东高考题)根据下面的反应路线及所给信息填空。
2.(04年广东高考题)根据下面的反应路线及所给信息填空。
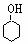
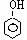

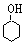
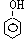



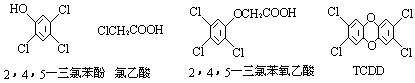

 2.以CH2 = CH2 和H218O 为原料,自选必要的其他无机试剂合成
2.以CH2 = CH2 和H218O 为原料,自选必要的其他无机试剂合成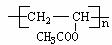
 羧酸酯RCOOR′在催化剂存在时可以跟醇R″OH发生如下反应(R′、R″是两种不同的烃基):RCOOR′+ R″OH
RCOOR″+ R′OH,此反应称为酯交换反应,常用于有机合成中。在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯
转化成聚乙烯醇,这一步就是用过量的甲醇进
羧酸酯RCOOR′在催化剂存在时可以跟醇R″OH发生如下反应(R′、R″是两种不同的烃基):RCOOR′+ R″OH
RCOOR″+ R′OH,此反应称为酯交换反应,常用于有机合成中。在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯
转化成聚乙烯醇,这一步就是用过量的甲醇进 【拓展】HOCH2CH2OH + 2Na
NaOCH2CH2ONa + H2
【拓展】HOCH2CH2OH + 2Na
NaOCH2CH2ONa + H2 【拓展】
【拓展】
 (1)具有酸性 如:
(1)具有酸性 如:



 (3)发生缩聚反应 如:
(3)发生缩聚反应 如: (4)发生氧化反应
如:
(4)发生氧化反应
如:
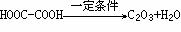

 (2)发生酯化反应。
(2)发生酯化反应。

 (5)具有还原性
(5)具有还原性 ②与新制的氢氧化铜碱性悬浊液反应
②与新制的氢氧化铜碱性悬浊液反应
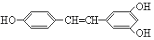
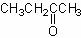



 不反应
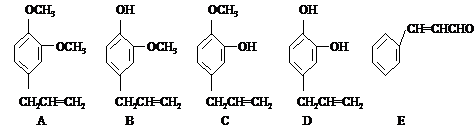
不反应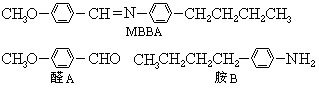 2.(93年北京题)液晶是一类新型材料.MBBA是一种研究得较多的液晶化合物.它可以看作是由醛A和胺B去水缩合的产物.
2.(93年北京题)液晶是一类新型材料.MBBA是一种研究得较多的液晶化合物.它可以看作是由醛A和胺B去水缩合的产物.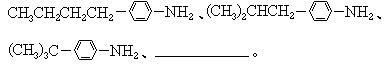 (1)对位上有-C4H9的苯胺可能有4个异构体,它们是:
(1)对位上有-C4H9的苯胺可能有4个异构体,它们是: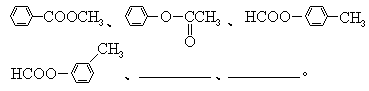 (2)醛A的异构体甚多.其中属于酯类化合物,而且结构式中有苯环结构的异构体就有6个,它们是:
(2)醛A的异构体甚多.其中属于酯类化合物,而且结构式中有苯环结构的异构体就有6个,它们是: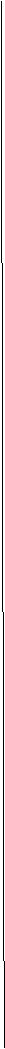 展望高考:
展望高考: 1.乙酸或乙酸钠在不同条件下可能在不同的部位(a、b、c)断键而起反应;
,试按下列要求各举一个实例(与出
1.乙酸或乙酸钠在不同条件下可能在不同的部位(a、b、c)断键而起反应;
,试按下列要求各举一个实例(与出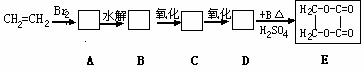
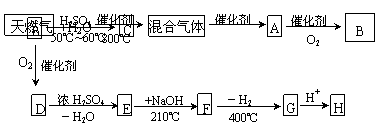

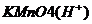 溶液褪色,油酸能使
溶液褪色,油酸能使 【例题解析】
【例题解析】

 +H2O
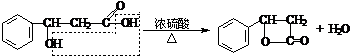
+H2O 某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。
某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。
 4.L?多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
4.L?多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下: A.洁净的试管;
A.洁净的试管;
 3.化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。
3.化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。
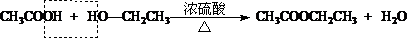

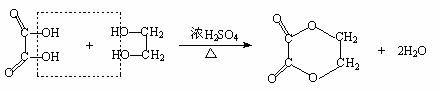



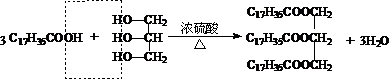
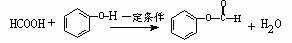
 易错点:
。
易错点:
。

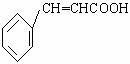
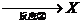
 B.乙酸乙酯中含有乙酸时,可用NaOH溶液除去
B.乙酸乙酯中含有乙酸时,可用NaOH溶液除去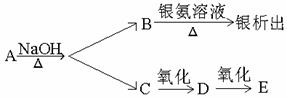
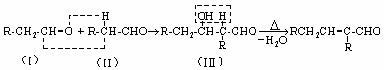
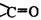 的化合物中,羰基碳原子与两个烃基直接相连时,叫做酮。当两个 烃基都是脂肪烃基时,叫脂肪酮,如甲基酮
的化合物中,羰基碳原子与两个烃基直接相连时,叫做酮。当两个 烃基都是脂肪烃基时,叫脂肪酮,如甲基酮
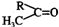 ;都是芳香烃基时,叫芳香酮;如两个烃基是相互连接的闭合环状结构时,叫环酮,如环己酮
;都是芳香烃基时,叫芳香酮;如两个烃基是相互连接的闭合环状结构时,叫环酮,如环己酮 。
。 (d)HCOOCH3
(d)HCOOCH3 是属于 (多选扣分)
是属于 (多选扣分) ,它不仅是一种家用杀虫剂,且是香料、塑料、医药工业重要原料,它的分子式为
。
,它不仅是一种家用杀虫剂,且是香料、塑料、医药工业重要原料,它的分子式为
。
 (3)实验操作
(3)实验操作


 所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里两种有机物的物质的量比约为5∶7。
所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里两种有机物的物质的量比约为5∶7。



 C.苯、四氯化碳、苯酚 D.裂化汽油、四氯化碳、己烯
C.苯、四氯化碳、苯酚 D.裂化汽油、四氯化碳、己烯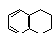
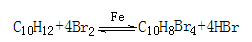 液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:
液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:
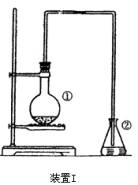


 2.单糖
2.单糖
 A.钠 B.硝酸 C.碘 D.新制氢氧化铜
A.钠 B.硝酸 C.碘 D.新制氢氧化铜
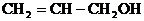 ;(2)
;(2)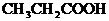 ;
;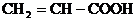 ;(4)葡萄糖,其中既能发生酯化反应,又 能发生加成反应,还能和新制的Cu(OH)2浊液反应的是
;(4)葡萄糖,其中既能发生酯化反应,又 能发生加成反应,还能和新制的Cu(OH)2浊液反应的是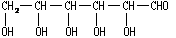 (简写为GCHO)
(简写为GCHO) 最难。
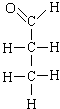
最难。
 B.
B.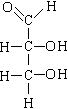
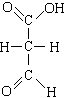 D.
D.
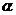 ―氨基酸
―氨基酸 的化工原料。油脂的以下性质和用途与其含有的不饱和双键( C=C )有关的是
的化工原料。油脂的以下性质和用途与其含有的不饱和双键( C=C )有关的是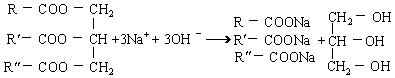
 CH3COO- + NH4++2Ag¯+3NH3+H2O
CH3COO- + NH4++2Ag¯+3NH3+H2O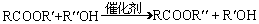 ,此反应称为酯交换反应,常用于有机合成中。在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯
,此反应称为酯交换反应,常用于有机合成中。在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯
 转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的。
转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的。
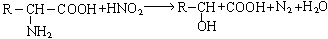

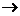 C
C
 )相同,且同时符合下列两个条件:①有带有两个取代基的苯环 ②有一个硝基直接连在苯环上的异构体的数目是
)相同,且同时符合下列两个条件:①有带有两个取代基的苯环 ②有一个硝基直接连在苯环上的异构体的数目是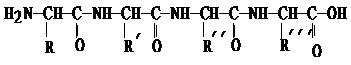
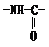
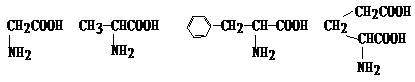 得到下列四种氨基酸:
得到下列四种氨基酸: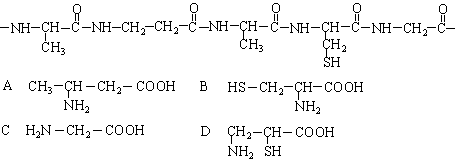


 C C
C C C C
C C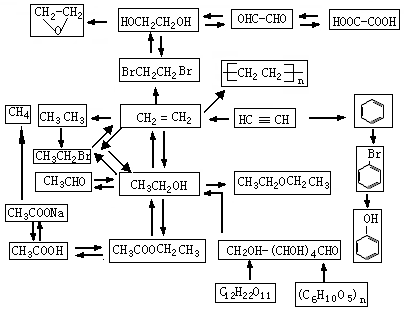
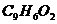 ,分子中除有一个苯环外,还有一个六元环。已知有机物
,分子中除有一个苯环外,还有一个六元环。已知有机物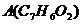 和
和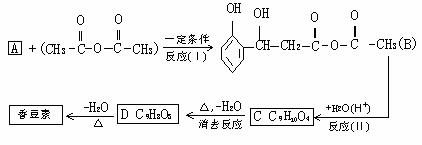
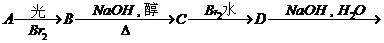



 注:
注:
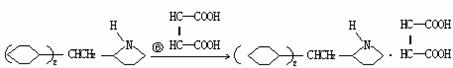
 B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示。
B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示。
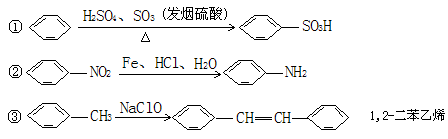
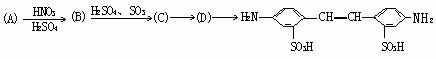

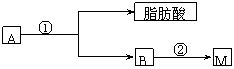




 式中C6H5为苯基。
式中C6H5为苯基。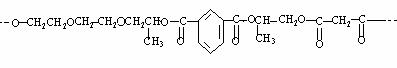
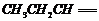
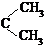
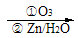
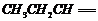
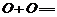
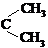
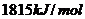 ,丙酮的燃烧热为
,丙酮的燃烧热为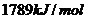 ,试写出丙醛燃烧的热化学方程式
。
,试写出丙醛燃烧的热化学方程式
。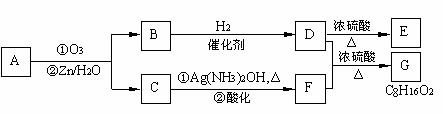
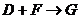 的化学方程式是:
。
的化学方程式是:
。 已知CH3CH2OH CH3C
OO CH2 CH3
已知CH3CH2OH CH3C
OO CH2 CH3

 (2)写出化合物A和F结构简式
(2)写出化合物A和F结构简式
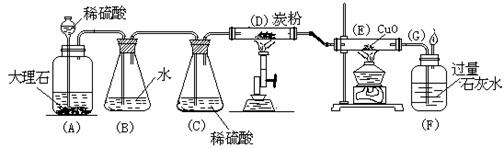

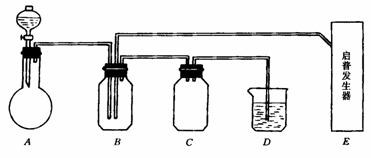
 5.某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。
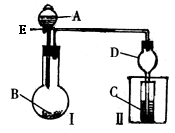
5.某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。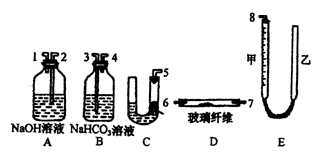
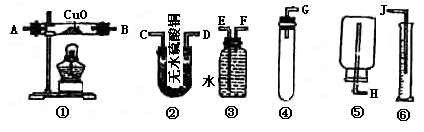



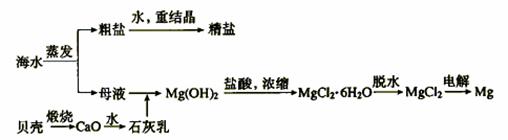
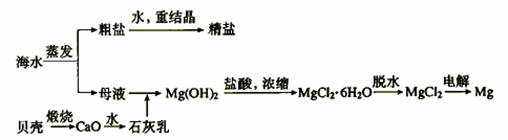
 粗盐 精盐
粗盐 精盐


 贝壳 CaO 石灰乳
贝壳 CaO 石灰乳
 的是___________,原因是_________。
的是___________,原因是_________。