16.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | 元素周期表第ⅠA族元素都是金属元素 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
15.下列说法不正确的是( )
| A. | 不可将水直接倒入浓硫酸中进行稀释 | |
| B. | 浓硫酸可用于干燥O2、CO2 | |
| C. | 硝酸与铁反应可产生H2 | |
| D. | 浓硫酸对皮肤或衣服有很强的腐蚀性 |
13.下列物质的熔、沸点高低顺序不正确的是( )
| A. | F2<Cl2<Br2<I2 | B. | CF4>CCl4>CBr4>CI4 | ||
| C. | HCl<HBr<HI<HF | D. | CH4<SiH4<GeH4<SnH4 |
11.下列变化中,不需要破坏化学键的是( )
| A. | 氯化氢溶于水 | B. | 氯化铵受热分解 | C. | 干冰升华 | D. | 氯化钠熔化 |
10.短周期元素的简单离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 元素非金属性:Y>Z | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子半径:X+<Z- |
7.化学反应可视为旧键断裂和新键形成的过程.共价键的键能是两种原子间形成1mol共价键(或其可逆过程)时释放(或吸收)的能量.已知H-H 键的键能为436kJ•mol-1、Cl-Cl键的键能为243kJ•mol-1、H-Cl键的键能为X,若1molH2(g)与1mol Cl2(g)反应生成2mol HCl(g)放出 183kJ的热量,则X为( )
0 168781 168789 168795 168799 168805 168807 168811 168817 168819 168825 168831 168835 168837 168841 168847 168849 168855 168859 168861 168865 168867 168871 168873 168875 168876 168877 168879 168880 168881 168883 168885 168889 168891 168895 168897 168901 168907 168909 168915 168919 168921 168925 168931 168937 168939 168945 168949 168951 168957 168961 168967 168975 203614
| A. | 496 kJ•mol-1 | B. | 431 kJ•mol-1 | C. | 862 kJ•mol-1 | D. | 248 kJ•mol-1 |
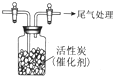 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究. A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.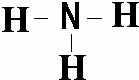 .
.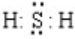 .
.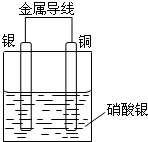 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告. .
.