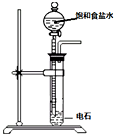
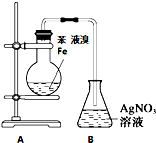
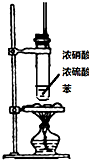
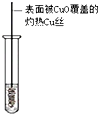
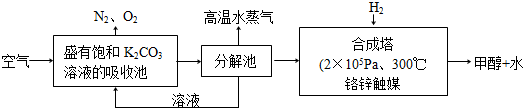
9.下列实验操作对应的实验现象及解释或结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 用某无色溶液进行焰色反应 | 焰色呈黄色 | 原溶液一定是钠盐溶液 |
| B | 向NaOH溶液中滴加足量的MgCl2 溶液,然后再滴加足量的CuCl2溶液 | 先产生白色沉淀, 然后沉淀变蓝色 | KSP[Cu(OH)2]>KSP[Mg(OH)2] |
| C | 将水蒸汽通过灼热的铁粉 | 粉末变红 | 铁与水蒸汽在高温下发生 反应 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g)═N2O4(g) △H<0 |
| A. | A | B. | B | C. | C | D. | D |
8.下列叙述中错误的是( )
| A. | 用水可以鉴别乙醇、苯、和溴苯 | |
| B. | 甲苯与氯气在光照下可发生取代反应,主要生成2,4-二氯甲苯 | |
| C. | 化学式为C7H16的有机物,分子中含有3个甲基的可能结构有3种 | |
| D. | 乙酸丁酯中含乙酸杂质,可以加入饱和碳酸钠溶液洗涤,然后通过分液来去除杂质 |
7.下列有关化学的基本概念、规律和原理正确的是( )
| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 不同元素的原子构成的分子中只含极性共价键 | |
| C. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
5.2014年,电池发展国际峰会召开,选定天津为金属空气电池研究基地.金属空气电池材料来源广,安全环保,能量密度大,是“面向21世纪新型绿色能源”可作为混合动力车的供电系统.Zn空气电池是利用较广的一种空气电池,放电时总反应方程为:2Zn+O2=2ZnO,其构造结构如图所示,下列说法正确的是( )
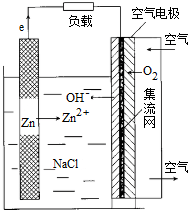

| A. | 放电时,电池正极反应式为:O2+H++4e-=2H2O | |
| B. | 增大空气进气口直径,可增大电池输出能力并延长电池使用寿命 | |
| C. | 放电时,每通入2.24L空气(标准状况),理论上负极需要消耗13gZn | |
| D. | 电池用完后,只需更换封装好的锌粉或电池锌板即可 |
4.下列说法正确的是( )
| A. | 含有CH3COONa的溶液都能增大水的电离程度 | |
| B. | pH=5的HCl与pH=5的NH4Cl等体积混合,溶液pH仍为5 | |
| C. | 将AgI和AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,产生的沉淀主要是AgBr | |
| D. | 20mL0.1mol/LNH3•H2O与10mL0.1mol/LHCl充分反应,所得溶液pH=9中c(NH3•H2O)>c(Cl-)>c(OH-) |
2.反应H2+Cl2=2HCl(△H<0)的机理包含:①Cl2→2Cl(慢)②H2+Cl→HCl+H(快)③Cl2+H→HCl+Cl(快)等.下列说法正确的是( )
0 168684 168692 168698 168702 168708 168710 168714 168720 168722 168728 168734 168738 168740 168744 168750 168752 168758 168762 168764 168768 168770 168774 168776 168778 168779 168780 168782 168783 168784 168786 168788 168792 168794 168798 168800 168804 168810 168812 168818 168822 168824 168828 168834 168840 168842 168848 168852 168854 168860 168864 168870 168878 203614
| A. | 断开1molH-H键需要的能量小于断开1molCl-Cl键需要的能量 | |
| B. | 反应在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能小于反应②的活化能 | |
| D. | 已知反应②的△H>0,则反应③的△H一定小于0 |