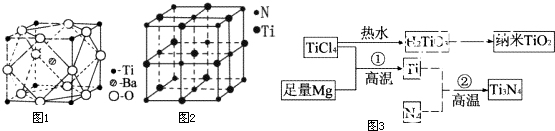
17.在大型演唱晚会上,观众经常使用荧光棒来增添喜庆气氛.荧光棒内草酸二苯酯和过氧化氢反应导致发光的原理大致如下:①草酸二苯酯+H2O2→C2O4+2C6H5OH;②生成的中间产物把能量传递给染料:C2O4+染料→染料*(电子激发态)+2CO2,电子激发态的染料不稳定,借发光而回到基态.下列说法不正确的是( )
| A. | 草酸二苯酯的分子式是C14H10O4 | |
| B. | 上述变化证明化学能可以转化为光能 | |
| C. | C2O4的结构简式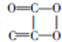 | |
| D. | 反应①属于酯水解反应 |
16.下列反应中,反应后固体物质质量不变的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
15.联苯(两个苯环单键相连)的二氯代物有( )
| A. | 10种 | B. | 11种 | C. | 12种 | D. | 13种 |
14.下列各离子组在溶液中能大量共存且通入括号中相应气体后,仍能大量共存的是( )
| A. | NH4+、Ca2+、HSO3-、Cl- (氨气) | B. | Ba2+、NO3-、Na+、Cl- (二氧化硫) | ||
| C. | Na+、K+、HCO3-、Cl- (二氧化碳) | D. | Al3+、SO42-、HCO3-、NO3- (氯化氢) |
13.下列有关叙述不正确的是( )
| 选项 | 已知 | 解释与结论 |
| A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
| B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
| C | 常温下,Ksp(AgCl)=1.8×10-10、 Ksp(AgBr)=5.4×10-13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=3×10-3 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
12.下列说法不正确的是( )
| A. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS在一定条件下可转化为CuS | |
| B. | 已知AgCl的Ksp=1.8×10-10,将0.01 mol•L-1KCl溶液和等体积的0.01 mol•L-1 AgNO3溶液混合,有AgCl沉淀析出 | |
| C. | 常温下,为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| D. | pH=8的Ba(OH)2溶液和pH=8的氨水中,由水电离的c(OH-)均为1×10-8 mol•L-1 |
11.下列实验操作与预期实验目的或所得实验结论都正确的是( )
0 168675 168683 168689 168693 168699 168701 168705 168711 168713 168719 168725 168729 168731 168735 168741 168743 168749 168753 168755 168759 168761 168765 168767 168769 168770 168771 168773 168774 168775 168777 168779 168783 168785 168789 168791 168795 168801 168803 168809 168813 168815 168819 168825 168831 168833 168839 168843 168845 168851 168855 168861 168869 203614
| 编号 | 实验操作 | 实验目的或结论 |
| A | 向某有机物中加入新制Cu(OH)2悬浊液并加热,有砖红色沉淀 | 该有机物一定是醛 |
| B | 将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,未产生浅黄色沉淀 | 证明CH3CH2Br未发生水解 |
| C | 分别给乙醇和苯酚溶液中加入紫色石蕊试液,观察其颜色的变化 | 比较乙醇和苯酚的酸性强弱 |
| D | 用pH试纸测定CH3COONa溶液的pH | 证明CH3COOH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |