4.下列各组物质中互为同位素的是( )
| A. | 氕和氘 | B. | H2O和D2O | C. | 石墨和金刚石 | D. | CH4和C3H8 |
1.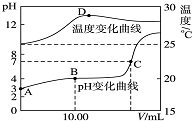 将1.00mol•L-1 NaOH溶液滴入20.00mL 1.00mol•L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示.下列说法正确的是( )
将1.00mol•L-1 NaOH溶液滴入20.00mL 1.00mol•L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示.下列说法正确的是( )
 将1.00mol•L-1 NaOH溶液滴入20.00mL 1.00mol•L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示.下列说法正确的是( )
将1.00mol•L-1 NaOH溶液滴入20.00mL 1.00mol•L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示.下列说法正确的是( )| A. | 室温时,HA的电离度约为10-6 | |
| B. | 图中B点时,溶液的KW略大于1×10-14 | |
| C. | 图中C点时,溶液中c(A-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 图中D点后,溶液温度略下降的主要原因是生成的 NaA水解吸热 |
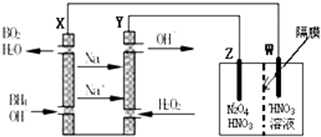
20.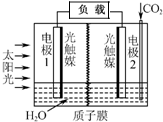 利用人工模拟光合作用合成甲酸的原理为:
利用人工模拟光合作用合成甲酸的原理为:
太阳能光触媒2CO2+2H2O $→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
 利用人工模拟光合作用合成甲酸的原理为:
利用人工模拟光合作用合成甲酸的原理为:太阳能光触媒2CO2+2H2O $→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
| A. | 电极1周围pH增大 | |
| B. | 电子由电极1经过负载流向电极2 | |
| C. | 电极2的反应式:CO2+2H++2e-=HCOOH | |
| D. | 该装置能将太阳能转化为化学能和电能 |
19.下列说法正确的是( )
| A. | 最简式为C2H4O的有机物一定可以发生银镜反应 | |
| B. | 不粘锅表面的高分子涂层可以由四氟乙烯通过缩聚反应合成 | |
| C. | 分子结构中含有4个甲基、碳原子数最少的烷烃的系统命名为:2,2-二甲基丙烷 | |
| D. | 甘油和甲苯只有在物质的量之比1:1混合时,充分燃烧后生成的水,才与等质量的甘油充分燃烧后生成的水相同 |
17.下列说法正确的是( )
0 168569 168577 168583 168587 168593 168595 168599 168605 168607 168613 168619 168623 168625 168629 168635 168637 168643 168647 168649 168653 168655 168659 168661 168663 168664 168665 168667 168668 168669 168671 168673 168677 168679 168683 168685 168689 168695 168697 168703 168707 168709 168713 168719 168725 168727 168733 168737 168739 168745 168749 168755 168763 203614
| A. | 强电解质一定易溶于水 | |
| B. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸的水的电离程度小 | |
| C. | 对可逆反应,升高温度一定存在v(正)>v(逆) | |
| D. | 钢铁在海水中发生电化腐蚀时,铁是正极被氧化 |
 .
.
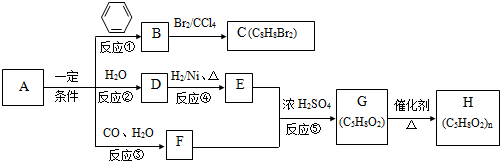
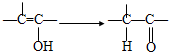
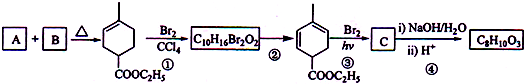
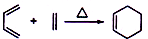
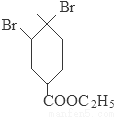 +2NaOH
+2NaOH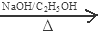
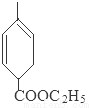 +2NaBr+2H2O;
+2NaBr+2H2O;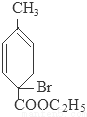 +2H2O
+2H2O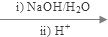
 +C2H5OH+HBr:
+C2H5OH+HBr: .
.
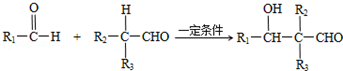 (R1、R2、R3代表烃基或氢原子)
(R1、R2、R3代表烃基或氢原子)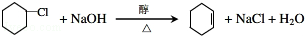 .
.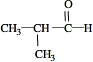 .
.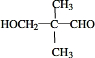 .若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).
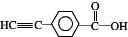
.若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).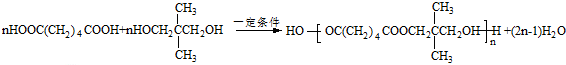 .
.
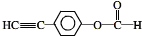 .
.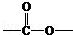 基团
基团