8.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| B. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA | |
| C. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA |
7.化学与生产生活息息相关,下列叙述正确的是( )
| A. | 次氯酸钠溶液作消毒剂,是因为钠盐能使蛋白质变性 | |
| B. | 工业电解熔融氧化铝冶炼铝,是因为氧化铝的成本比氯化铝低 | |
| C. | 生活中常用铁酱油、AD钙奶和钠盐,是因为铁、钙、碘都是人体必需元素 | |
| D. | 用硫化钠除去废水中的Hg2+、Cu2+,是因为硫化钠溶液是碱性,易生成氢氧化物沉淀 |
6.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol CH5+所含电子数为8nA | |
| B. | 标准状况下,11.2L Br2中Br原子数为nA | |
| C. | 1mol/L的Al2(SO4)3溶液中Al3+的数目小于2NA | |
| D. | 18g的D216O中含有的中子数为9 NA |
5.X、Y为同主族元素,Y的原子半径大于X.下列说法正确的是(m、n均为正整数)( )
| A. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| B. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| C. | 若HnY为气态,则HnX的熔、沸点一定比HnY低 | |
| D. | 若Y的最高正价为+7,则X的最高正价一定为+7 |
4.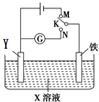 利用如图所示装置进行下列实验,下表中对应叙述正确的是( )
利用如图所示装置进行下列实验,下表中对应叙述正确的是( )
 利用如图所示装置进行下列实验,下表中对应叙述正确的是( )
利用如图所示装置进行下列实验,下表中对应叙述正确的是( )| A | X为硫酸氢钠,Y为石墨 K与M连接时;K与N连接时 | 一段时间后溶液的pH均增大 |
| B | X为氯化钠,Y为石墨 K与M连接时; K与N连接时 | 石墨电极反应均为: 4OH--4e-═2H2O+O2↑ |
| C | X为硫酸氢钠,Y为锌 K与M连接时; K与N连接时 | 铁电极反应均为: 2H++2e-═H2↑ |
| D | X为氯化钠,Y为锌 K与M连接时; K与N连接时 | 铁电极的保护方法均为: 牺牲阳极的阴极保护法 |
| A. | A | B. | B | C. | C | D. | D |
3.下列对各组离子或物质是否能够大量共存的判断及解释一定正确的是( )
| A | 25℃时,由水电离出来的c(H+)和c(OH-)的乘积为1×10-2 4的某溶液中: Fe2+、NO3-、AlO2-、Na+ | 不能共存 | 发生反应: 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O |
| B | 澄清石灰水中: Ca2+、K+、CH3COO-、HCO3- | 不能共存 | 发生反应: Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C | 常温常压下,空气中: NH3、NO、H2、CO2 | 可以共存 | 不能发生反应 |
| D | 银氨溶液中: K+、Na+、NO3-、Cl- | 可以共存 | 不能发生反应 |
| A. | A | B. | B | C. | C | D. | D |
2.工业上常用氯氧化法处理含氰(CN-)废水,反应原理为液氯在碱性条件下可以先将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一):KCN+2KOH+Cl2=KOCN+2KCl+H2O;氰酸盐再进一步被液氯氧化为无毒气体.下列说法不正确的是( )
| A. | KCN 与KOCN中氮元素的化合价均为-3价 | |
| B. | 氰酸盐进一步被氧化的产物之一是无毒的N2 | |
| C. | OCN-与CN-中σ键与π键个数比均为1:2 | |
| D. | 完全处理含0.1 mol CN-的废水,理论上需要消耗Cl2的体积为5.6L(标准状况下) |
1.下列说法中正确的是( )
| A. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | S、C、Si都是自然界中含量丰富的非金属元素,三种元素的二氧化物都属于酸性氧化物,均能与碱反应而不能与酸反应 | |
| D. | 碱性氧化物都是由金属元素和氧元素组成,如K2O、CuO、Na2O、Na2O2、Mn2O7、Fe2O3等全部由金属元素和氧元素组成的,因此都为碱性氧化物 |
20.羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与C02相似,高温下分解为CO和S.下列有关说法正确的是( )
0 168237 168245 168251 168255 168261 168263 168267 168273 168275 168281 168287 168291 168293 168297 168303 168305 168311 168315 168317 168321 168323 168327 168329 168331 168332 168333 168335 168336 168337 168339 168341 168345 168347 168351 168353 168357 168363 168365 168371 168375 168377 168381 168387 168393 168395 168401 168405 168407 168413 168417 168423 168431 203614
| A. | OCS中含有1个σ键和1个π键 | |
| B. | OCS高温分解时,碳元素化合价升高 | |
| C. | OCS、C02、CO、S晶体类型相同 | |
| D. | 22.4LOCS中约含有3×6.02×1023个原子 |
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题: