15.下列物质溶于水因水解而使溶液呈酸性的是( )
| A. | SO2 | B. | NaHSO3 | C. | CH3COONa | D. | FeCl2 |
11.以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.4kJ/mol;完成下列填空:
(1)上述反应在高温(填高温、低温、任何温度)下能自发进行.
(2)该反应平衡常数K的表达式K=$\frac{{c}^{4}(N{H}_{3})•{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})}$.
(3)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则ac.
a.平衡常数K增大 b.H2O的浓度减小 c.容器内的压强增大 d.v逆(O2)减小
(4)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见表:
第四组实验中以NH3表示反应的速率是33×10-7mol/L•h,与前三组相比,NH3 生成量最小的原因可能是催化剂在80℃活性减小,反应速率反而减慢.
(5)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是NH4Cl.请用电离平衡理论解释上述实验现象饱和H2CO3溶液中电离产生的CO32-很少,因此没有沉淀,加入氨水后,促进H2CO3的电离,CO32-离子浓度增大,有沉淀产生.
②向盐酸中滴加氨水过量至溶液呈中性,则离子浓度的关系是c(NH4+)>c(OH-)>c(Cl-)>c(H+).
(1)上述反应在高温(填高温、低温、任何温度)下能自发进行.
(2)该反应平衡常数K的表达式K=$\frac{{c}^{4}(N{H}_{3})•{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})}$.
(3)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则ac.
a.平衡常数K增大 b.H2O的浓度减小 c.容器内的压强增大 d.v逆(O2)减小
(4)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
(5)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是NH4Cl.请用电离平衡理论解释上述实验现象饱和H2CO3溶液中电离产生的CO32-很少,因此没有沉淀,加入氨水后,促进H2CO3的电离,CO32-离子浓度增大,有沉淀产生.
②向盐酸中滴加氨水过量至溶液呈中性,则离子浓度的关系是c(NH4+)>c(OH-)>c(Cl-)>c(H+).
10.分子式为C6H14O且在铜或银做催化剂的条件下,可以被空气中的氧气氧化成醛的醇有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
9.已知0.1mol•L-1的三元酸H3A溶液的pH=4.0,则下列说法中正确的是( )
| A. | 在Na3A、Na2HA、NaH2A三溶液中,离子种类不相同 | |
| B. | 在溶质物质的量相等的Na3A、Na2HA、NaH2A三溶液中阴离子总数相等 | |
| C. | 在NaH2A溶液中一定有c(Na+)+c(H+)=c(OH-)+c(H2A-)+c(HA2-)+c(A3-) | |
| D. | 在Na3A溶液中一定有:c(H+)=c(OH-)-c(HA2-)-2c(H2A-)-3c(H3A) |
8.水系锂电池具有安全、环保和价格低廉等优点成为当前电池研究领域的热点.以钒酸钠(NaV3O8)为正极材料的电极反应式为:NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )


| A. | 放电时,该电池的总反应为:xLi+NaV3O8═NaLixV3O8 | |
| B. | 充电过程中Li+从阳极向阴极迁移 | |
| C. | 充电过程中阳极的电极反应式为NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 | |
| D. | 该电池可以用硫酸钠溶液作电解质 |
7. 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )
 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )| A. | CO2(NaHCO3溶液)无色喷泉 | B. | NH3(H2O含酚酞)红色喷泉 | ||
| C. | Cl2(NaOH溶液)无色喷泉 | D. | HCl(AgNO3溶液)白色喷泉 |
6.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性.制备时将FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色、分散质粒子直径在5.5nm~36nm的磁流体.下列说法正确的是( )
0 168198 168206 168212 168216 168222 168224 168228 168234 168236 168242 168248 168252 168254 168258 168264 168266 168272 168276 168278 168282 168284 168288 168290 168292 168293 168294 168296 168297 168298 168300 168302 168306 168308 168312 168314 168318 168324 168326 168332 168336 168338 168342 168348 168354 168356 168362 168366 168368 168374 168378 168384 168392 203614
| A. | 所得的分散系属于胶体,可发生丁达尔效应 | |
| B. | 所得的分散系中,分散质的主要成分为FeO | |
| C. | 该分散系进行电泳实验时,阳极周围黑色加深 | |
| D. | 往油酸钠水溶液中滴加浓溴水振荡,无明显现象 |

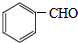
 $\stackrel{KMnO_{4}/H+}{→}$RCOOH+
$\stackrel{KMnO_{4}/H+}{→}$RCOOH+
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O
+H2O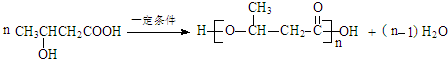 .
. .
. .
.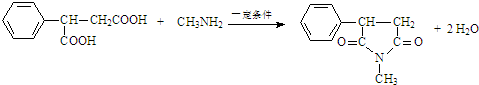 .
.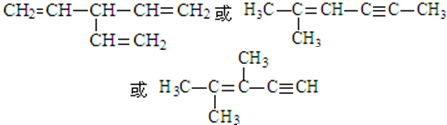 (写出一种即可).
(写出一种即可). 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”).
,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.