��Ŀ����
�״���һ�����ʵ�Һ��ȼ�ϣ�CO��CO2�������ںϳɼ״���
Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���һ�������·�����Ӧ��
CO2(g) +3H2(g) ��CH3OH(g)+H2O(g) ��H1
��1����֪��2CO(g) +O2(g) ��2CO2(g) ��H2
2H2(g)+O2(g) ��2H2O(g) ��H3
��CO(g) + 2H2(g)  CH3OH(g)�ġ�H�� ��
CH3OH(g)�ġ�H�� ��
��2����CO�ϳɼ״�ʱ��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ��
�÷�Ӧ��H 0���>���� <������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������� ��
��3��
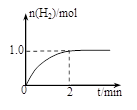
һ���¶��£���2L�ܱ������м���1mol CH3OH (g)��������Ӧ��CH3OH(g)  CO(g) + 2H2(g)��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��0~2 min�ڵ�ƽ����Ӧ����v(CH3OH)= ��
CO(g) + 2H2(g)��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��0~2 min�ڵ�ƽ����Ӧ����v(CH3OH)= ��
���¶��£�CO(g) + 2H2(g)  CH3OH(g)��ƽ�ⳣ��K= ��
CH3OH(g)��ƽ�ⳣ��K= ��
��ͬ�¶��£�����ʼ����CH3OH(g)�����ʵ�����ԭ����2������ ��ԭ����2����
a��ƽ�ⳣ�� b��CH3OH��ƽ��Ũ�� c���ﵽƽ���ʱ�� d��ƽ��ʱ������ܶ�
��4����CH3OHΪȼ�ϣ���KOH��Һ���������Һ�����Ƴ�CH3OHȼ�ϵ�ء�
�ٳ���CH3OH�ĵ缫Ϊ ����
�ڸ�����Ӧ�ĵ缫��ӦʽΪ ��
��1����H1+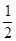 ��H2 ��
��H2 ��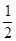 ��H3 ����2�֣�
��H3 ����2�֣�
��2��<����1�֣� ��1.3��104kPa�£�CO��ת�����Ѿ��ܸߣ��������ѹǿCO��ת������߲��������ɱ����ӣ��ò���ʧ����3�֣�
��3��0.125mol��L��1�� min��1����2�֣� 4 L2��mol��2����2�֣� d����1�֣�
��4���ٸ�����1�֣� ��CH3OH �� 6e��+8OH��= CO32��+6H2O����2�֣�
����


 CH3OH(g)���ġ���H��
��
CH3OH(g)���ġ���H��
��
