题目内容
将19.2g的铜和某浓度的硝酸反应,生成8.96L(标况)的气体,则参加反应的硝酸为 moL,将这8.96L的气体和标况下 L的氧气混合,再通入水中没有气体剩余.
【答案】分析:根据N守恒,参加反应的硝酸n(HNO3)=2n(Cu(NO3)2)+n(NO)+n(NO2)=2n(Cu)+n(NO)+n(NO2);根据产生的气体和氧气最终变为硝酸,在上述两个过程中只有两种元素铜、氧的化合价发生变化,根据电子得失守恒,可求得氧气.
解答:解:因N守恒,所以参加反应的硝酸n(HNO3)=2n(Cu(NO3)2)+n(NO)+n(NO2)=2n(Cu)+n(NO)+n(NO2)=
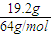 ×2+
×2+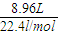 =1mol;
=1mol;
因产生的气体和氧气最终变为硝酸,在上述两个过程中只有两种元素铜、氧的化合价发生变化,根据电子得失守恒,则
n(O2)×4=n(Cu)×2,即n(O2)=n(Cu)× =
=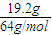 ×
× =0.15mol,体积为3.36L,
=0.15mol,体积为3.36L,
故答案为:1;3.36.
点评:本题考查硝酸的性质及根据性质进行计算,硝酸具有强氧化性和酸性,可以和不活泼金属如铜发生反应,既表现酸性又表现强氧化性,计算时注意守恒法的应用
解答:解:因N守恒,所以参加反应的硝酸n(HNO3)=2n(Cu(NO3)2)+n(NO)+n(NO2)=2n(Cu)+n(NO)+n(NO2)=
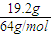 ×2+
×2+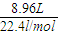 =1mol;
=1mol;因产生的气体和氧气最终变为硝酸,在上述两个过程中只有两种元素铜、氧的化合价发生变化,根据电子得失守恒,则
n(O2)×4=n(Cu)×2,即n(O2)=n(Cu)×
 =
=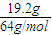 ×
× =0.15mol,体积为3.36L,
=0.15mol,体积为3.36L,故答案为:1;3.36.
点评:本题考查硝酸的性质及根据性质进行计算,硝酸具有强氧化性和酸性,可以和不活泼金属如铜发生反应,既表现酸性又表现强氧化性,计算时注意守恒法的应用

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目